Efecto de suspensión de alimentación sobre la lesión intestinal aguda relacionada con la transfusión en prematuros : estudio piloto aleatorizado y controlado
Suzan Sahin
The Journal of Maternal-Fetal & Neonatal Medicine
Marzo 2019
Introducción
Varios estudios retrospectivos han
reportado aumento en la enterocolitis necrotizante (NEC) durante las 48 horas
posteriores a la transfusión de glóbulos rojos (RBC) en recién nacidos
prematuros. Se han inventado dos acrónimos descriptivos para describir esta
asociación : enterocolitis necrotizante asociada a transfusión (TANEC) y
lesión intestinal aguda asociada a transfusión (TRAGI). Los mecanismos
propuestos para TRAGI incluyen una reacción directa a algún componente del
producto sanguíneo transfundido, una alteración en el flujo sanguíneo
mesentérico y una disminución de la entrega de oxígeno al tejido intestinal por
los glóbulos rojos almacenados, lo que conduce a isquemia y vasoconstricción en
el intestino [1, 2]. Un metaanálisis de estudios observacionales retrospectivos
demostró asociación entre transfusión de glóbulos rojos y mayor riesgo
de ECN (odds ratio ajustado, 2.0 [IC 95%, 1.6-2.5]) [3].
TRAGI puede representar el 20-41% de todos los casos de NEC, siendo la mayoría quirúrgicos o NEC en etapa 3 [3, 4]. Del mismo modo, un análisis retrospectivo de la base de datos de la Red Neonatal Canadiense encontró que la transfusión en los 2 días anteriores era un factor de riesgo independiente para NEC [5]. Dado que NEC es la causa más común de muerte entre las 2 y 8 semanas de edad en neonatos extremadamente prematuros [6] y que esta población vulnerable constituye el grupo de pacientes transfundidos con más frecuencia con más de la mitad de los prematuros de muy bajo peso al nacer (MBPN, ≤ 1,500 g) que reciben 1 o más transfusiones [7], las estrategias para disminuir el riesgo de TRAGI serían de gran valor. Los estudios realizados hasta la fecha sobre el beneficio de la suspensión de las alimentaciones durante la transfusión de glóbulos rojos para prevenir TRAGI han sido observacionales.
Un metaanálisis
reciente de los resultados de 7 estudios no RCT (randomizados, controlados) (2
artículos publicados y 5 resúmenes, n = 7.492) mostró que la suspensión de la
alimentación durante la transfusión de glóbulos rojos redujo significativamente la
incidencia de TRAGI (RR: 0,47; IC del 95%: 0,28 a 0,80; P = 0,005; I 2 = 11%). La
calidad general de la evidencia fue moderada y la conclusión del metanálisis fue
que se necesitaban estudios controlados , empoderados, randomizados de alimentación
durante la transfusión [8]. Hasta donde sabemos, presentamos el
primer estudio piloto prospectivo randomizado para investigar el efecto de la
suspensión de alimentación durante la transfusión de glóbulos rojos en
prematuros de muy bajo peso al nacer, principalmente en el desarrollo de NEC.
Métodos
Este estudio prospectivo randomizado,
controlado, de
un solo centro se realizó en la Unidad de Cuidados Intensivos
Neonatales del Hospital docente de Maternidad Zekai Tahir Burak en Ankara,
Turquía, entre diciembre de 2013 y enero de 2015. El comité de ética local
aprobó el estudio (aprobación número : 12/2013) y se obtuvo el consentimiento
informado por escrito parental para cada paciente antes del enrolamiento. El estudio se
registró en ClinicalTrials.gov (identificador: NCT02132819). Los recién nacidos
prematuros inborn (nacidos en el hospital) con EG ≤ 32 semanas y / o peso al nacer ≤ 1500 gr que sobrevivieron
los primeros 7 días de vida y que estaban tolerando la alimentación enteral completa
(130-180 ml / kg / d) fueron elegibles para enrolamiento. Se excluyeron los
neonatos con anomalías congénitas o anomalías cardíacas complejas, hipoxia
severa, asfixia y que ya estaban con NPO (régimen 0) debido a alteraciones hemodinámicas y
transfusiones en los primeros 7 días de vida. Se realizó una randomización
basada en web no estratificada y se utilizaron sobres opacos sellados numerados
secuencialmente. Luego, el neonato randomizado permaneció en el mismo brazo
durante todo el período de hospitalización por transfusiones repetitivas. Como
política de la unidad, todos los prematuros son alimentados en las
primeras 24 horas de vida cada 2 horas con una dosis inicial de 20 ml / kg / día
si no hay contraindicaciones médicas. La leche materna es la primera opción, se
administró una fórmula para prematuros cuando no se pudo proporcionar leche
materna. La leche de donante no se usó ya que no tenemos banco de leche.
La decisión de transfundir fue tomada por
el neonatólogo a cargo basándose en un protocolo comúnmente utilizado en la
unidad diseñado no específicamente para el estudio ni por los investigadores (los
umbrales de transfusión fueron los siguientes; Hct 35%: ventilación cardíaca
mecánica, enfermedad grave o enfermedad cardíaca congénita crítica) , Hct 25%:
signos de anemia, letargo inexplicable, aumento de peso < 10 g / kg a pesar de
calorías adecuadas, frecuencia cardíaca > 165 / lpm durante> 48 horas, apnea
inexplicable, Hct 20%: incluso si no se detectan signos de anemia) . Los
neonatos enrolados recibieron glóbulos rojos empaquetados 15 ml / kg durante
3 horas. Los neonatos cuyas alimentaciones fueron suspendidas durante la transfusión
constituyeron el grupo NPO (nada por boca) y aquellos que continuaron recibiendo alimentación
durante la transfusión constituyeron el grupo FED. En el grupo de NPO, se
suspendieron 1-2 alimentaciones antes, 1-2 alimentaciones después y la alimentación
durante la transfusión y se proporcionaron 120 ml / kg / día de solución mixta
dextrosa / salina por vía intravenosa. Esto proporcionó
aproximadamente 8-12 horas de tiempo sin nada por os (NPO).
La alimentación comenzó con el volumen
previo a la transfusión que sincroniza el primer momento de alimentación después
de la transfusión de glóbulos rojos. La infusión intravenosa se suspendió después de una
alimentación completa sin incidentes. Los neonatos incluídos fueron observados
de cerca durante 72 horas después de la transfusión en busca de evidencia de
intolerancia alimentaria y / o NEC. La intolerancia alimentaria se definió como >
2 episodios de residuo gástrico > 50 % del volumen de alimentación
previo,
residuos biliosos, vómitos, hematoquecia o distensión abdominal (definida como
aumento de 2 cm en la circunferencia abdominal en cualquier día durante las
72 horas posteriores a la transfusión) .
La estadificación de NEC se realizó de acuerdo con los criterios de Bell modificados. Se incluyeron en el análisis casos de etapa ≥ 2 NEC que fueron examinados tanto por el médico del equipo de investigación como por el neonatólogo consultor. Los neonatos fueron monitoreados con el oxímetro de pulso Masimo Set Radical 7 (Masimo Corp., Irvine, CA, EE. UU.). El índice de perfusión posductal (PI) se registró manualmente cada 10 s durante 3 minutos en dos períodos de tiempo definidos: justo antes y 6-8 horas después de la transfusión. Se registraron los valores de PI antes y después de la transfusión, los niveles de hemoglobina y hematocrito.
Los outcomes primarios fueron aumento en la circunferencia abdominal y desarrollo de NEC (etapa ≥ 2) durante las primeras 72 horas después de la transfusión. Otras morbilidades comunes de la prematuridad, tales como displasia broncopulmonar (DBP) y retinopatía del prematuro (ROP), conducto arterioso permeable (DAP), duración de la hospitalización y mortalidad que pueden estar relacionadas por el resultado primario fueron registradas como outcomes secundarios.
DBP se diagnosticó según los criterios diagnósticos de los Institutos Nacionales de Salud y Desarrollo Infantil y la ROP fue diagnosticada considerando la Clasificación Internacional. El DAP hemodinámicamente significativo fue diagnosticado por un cardiólogo pediátrico con los siguientes signos ecocardiográficos : flujo de turbulencia diastólica en arteria pulmonar (derivación de izquierda a derecha), relación aurícula izquierda / diámetro de raíz aórtica > 1.5, tamaño ductal > 1.5 mm, además de evidencia clínica. El comité de ética no permitió ninguna randomización adicional debido a las bajas tasas de NEC y la falta de beneficio para disminuir las tasas de NEC del ayuno durante la transfusión de glóbulos rojos como se reportó en el análisis intermedio.
Análisis estadístico
Como este es el primer estudio prospectivo aleatorizado de suspensión versus mantención de alimentación durante la transfusión de glóbulos rojos en NEC, no fue posible un cálculo preciso del tamaño de la muestra basado en datos preliminares. Los autores eligieron el número target de episodios de transfusión para este estudio piloto (150) en función de la factibilidad con la intención de generar datos preliminares para un futuro estudio más grande. Los cálculos del tamaño de la muestra para una posible prueba futura se realizaron en https://clincalc.com/stats/samplesize.aspx asumiendo alfa = 0.05 y poder del 80%.
La evaluación estadística de los datos se realizó utilizando el
software SPSS, versión 20.0 (IBM SPSS Statistics, IBM Corporation, Armonk, NY).
Los datos normalmente distribuidos se dan como promedio y DE, otros se presentan
como mediana y rango. Los porcentajes y los promedios se compararon entre los 2
grupos con la prueba exacta de Fisher, la prueba de chi al cuadrado y el T test , según corresponda. Se usó una prueba t pareada de dos colas para comprobar
las diferencias en las mediciones de PI posductales antes y después de la
transfusión de sangre; p < 0.05 se consideró significativo. La prueba de
correlación de Spearman se realizó para el análisis de correlación; p < 0.05 se
consideró significativo.
Resultados
Durante el período de estudio, se evaluó
para elegibilidad de 165 neonatos con edades gestacionales de 24-32 semanas y 244
episodios de transfusión de glóbulos rojos. 53 niños y 83 episodios de
transfusión fueron excluidos debido a los criterios de exclusión antes
mencionados. Un total de 112 recién nacidos randomizados sea a recibir
transfusiones con alimentaciones suspendidas durante un período de 8-12 horas
durante el período peritransfusional (grupo NPO) o para recibir la transfusión con
alimentación enteral completa simultánea (grupo FED) y se observaron 161
episodios de transfusión. Después de la randomización , se excluyeron 7
episodios de transfusión. 5 fueron excluidos debido a una transfusión por
segunda vez sin permanecer en el mismo brazo y 2 fueron excluidos por ser
transferidos a otra UCIN antes de las 72 horas después de la transfusión.
Finalmente, se analizaron 110 neonatos y 154 transfusiones (74 NPO y 80 FED)
. Volvimos a analizar los datos, incluidas las 5 transfusiones, tanto
por intención de tratar (según la aleatorización original) como por el
tratamiento real recibido y no encontramos diferencias en los resultados.
Las características de los neonatos
que se resumen en Tabla 1 fueron similares entre los dos grupos. Dos de los
80 episodios de transfusión en el grupo FED fueron seguidos por NEC (ambos
casos fueron diagnosticados dentro de las 24 horas posteriores a la
transfusión), mientras que no se observó NEC en el grupo e NPO (p = 0,49).
Tabla 1.- Características demográficas de los grupos
|
|
NPO GROUP (n=52) |
FED GROUP (n=58) |
P |
|
Gestational Age,(weeks, mean±SD) |
27.3±2.5 |
27.6±2.3 |
NS |
|
Birth Weight (gr, mean ±SD) |
981±288 |
957±261 |
NS |
|
Antenatal Steroid, n (%) |
25 (48) |
28 (48) |
NS |
|
Chorioamnionitis, n (%) |
9 (17) |
7 (12) |
NS |
|
CRIB Score, median (minmax) * |
4 (0-15) |
4 (0-15) |
NS |
|
APGAR 5 minutes median (min-max) |
6 (1-9) |
7 (3-9) |
NS |
|
Gender,male n(%) |
28 (54) |
34 (59) |
NS |
|
SGA, n(%) |
9 (17.3) |
12 (20.6) |
NS |
|
Exclusively formula fed n (%) |
12 (23) |
17 (29.3) |
NS |
|
Age at transfusión, mean ±SD (days) |
23.2±3.9 |
26.5±4.2 |
NS |
|
* CRIB: Clinical risk index for babies SGA: small for gestational age |
|||
Cambio en las circunferencias abdominales se representan en Tabla 2 tanto antes como después de la transfusión y días consecutivos después de la transfusión. Se observó intolerancia alimentaria después de 4 transfusiones en el grupo FED, mientras que esto se observó en 1 neonato en el grupo NPO (p = 0,36). Las medidas adicionales de morbilidad se resumen en Tabla 2 sin diferencias estadísticamente significativas entre los 2 grupos para los outcomes secundarios, aunque se observó una tendencia hacia una mayor mortalidad en el grupo FED (6,8% frente a 0%, p = 0,06).
Table 2. - Comparison of neonatal morbidities and mortality
|
|
NPO GROUP (n=52) |
FED GROUP (n=58) |
P |
|
MV requirement (days, mean ±SD) |
13±29 |
17±33 |
0.13 |
|
Supplemental O2 requirement (days, mean ±SD) |
57±42 |
75±82 |
0.06 |
|
PDA, n (%) |
20 (38) |
26 (45) |
0.21 |
|
ROP, n (%) |
8 (15) |
13 (22) |
0.25 |
|
NEC, n (%) |
0 (0) |
2 (3.4) |
0.49 |
|
Feeding Intolerance, n (%) |
1 (1.9) |
4 (6.8) |
0.36 |
|
Abdominal circumference pretx,(cm, mean±SD) |
24.6±2.9 |
24.5±3.1 |
0.74 |
|
Abdominal circumference posttx,(cm, mean±SD) |
24.8±3.1 |
24.6±3.1 |
0.70 |
|
Abdominal circumference 2nd day (cm, mean±SD) |
24.8±3 |
24.2±2.7 |
0.18 |
|
Abdominal circumference 3rd day (cm, mean±SD) |
24.4±2.8 |
24.3±2.6 |
0.76 |
|
BPD, n (%) |
32 (62) |
35 (60) |
0.73 |
|
Duration of hospitalization, (days, mean±SD) |
74±24 |
86±39 |
0.19 |
|
Mortality, n (%) |
0 (0) |
4 (6.8) |
0.06 |
|
MV: Mechanical Ventilation, PDA: Patent ductus arteriosus, ROP: Retinopathy of prematurity, NEC: Necrotizing Enterocolitis, TX: transfusion, BPD: Bronchopulmonary dysplasia |
|||
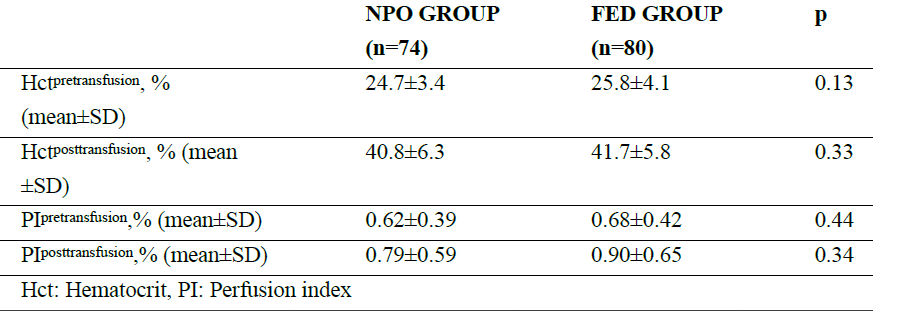
La causa de la muerte en 4 neonatos se debió a sepsis de inicio tardío en grupo FED. De los 2 casos de NEC, ninguno de los neonatos murió. Se encontró que el outcome combinado de alteración gastrointestinal (intolerancia alimentaria y / o NEC) y mortalidad aumentó significativamente en grupo de FED (17.2% vs 1.9%, p = 0.009). Los valores de hematocrito y PI antes de la transfusión fueron similares en ambos grupos (Tabla 3). Los valores de hematocrito y PI posductales aumentaron en un grado similar después de la transfusión en cada grupo. No se observó relación entre los valores de Hct pretransfusión y NEC (r = -0.06, p = 0.5) o incidencia de intolerancia alimentaria (r = 0.08, p = 0.36).
Table 3.- Pre and post-transfusion Hematocrit and Perfusion Index Measurements
Discusión
Aún se desconoce si la transfusión de
glóbulos rojos, la anemia grave o ambas están asociadas con un mayor riesgo de
ECN. En este ensayo piloto aleatorizado controlado, nuestro objetivo fue
investigar prospectivamente el efecto de la suspensión de alimentaciones durante la
transfusión de glóbulos rojos en recién nacidos prematuros con MBPN en el
desarrollo de NEC. Este estudio tenía poco poder para sacar conclusiones firmes,
pero nos guió a generar datos preliminares para un cálculo de tamaño de
muestra más preciso. Cuando comparamos los resultados de este estudio con tres
estudios retrospectivos publicados sobre suspensión de alimentaciones durante la
transfusión, asumimos que para tener un estudio prospectivo aleatorizado con
potencia adecuada, se requieren al menos 600 episodios de transfusión para
confirmar una disminución en TRAGI causada por la suspensión de las
alimentaciones durante
la transfusión de glóbulos rojos [4 , 9, 10]. Esto es consistente con los
estudios retrospectivos que reportaron tasas de todos los casos de NEC
durante los períodos de NPO versus mantención de alimentación durante las
transfusiones, sin embargo, incluso un estudio de este tamaño puede tener poca
potencia en función del estudio retrospectivo único que consideró solo los casos
de TRAGI [4, 9, 10].
Se hipotetiza que la anemia severa causa hipoxia intestinal y estrés oxidativo durante la reperfusión aguda [11, 12]. Singh et al demostraron que cada disminución de punto porcentual en el nivel de hematocrito medido más bajo se asoció con mayor riesgo de ECN en lactantes con MBPN [13]. Se ha informado de la evidencia de que tanto la transfusión en sí misma como el grado de anemia previa a la transfusión son factores de riesgo para NEC [14]. Sin embargo, en nuestro estudio, no se observó relación entre los valores de Hct previos a la transfusión y la incidencia de intolerancia alimentaria / NEC. Esto puede atribuirse al protocolo de transfusión que se eligió, bajo tamaño de muestra o incidencia relativamente baja de NEC en esta cohorte de estudio. La determinación del PI (índice de perfusión) no es invasiva y simple, y en estudios recientes se ha sugerido como una forma alternativa de monitorizar la condición hemodinámica general de los recién nacidos prematuros [15].
Se incluyeron los valores de PI antes y después de la transfusión para evaluar la hipótesis de que las mediciones de perfusión deficiente antes de la transfusión o cambios más grandes en la PI durante o después de la transfusión se asocian con TRAGI en los recién nacidos prematuros anémicos. Desafortunadamente, el bajo número de casos de NEC impidió la prueba de estas hipótesis.
Si bien la alimentación es claramente un factor de riesgo en la NEC clásica , siendo la leche humana y protocolos de alimentación protectores [16-18], si la alimentación (ya sea tipo o volumen) juega un rol en TRAGI sigue siendo incierto. La interrupción completa de la alimentación (NPO) no está exenta de riesgos, ya que la perfusión intestinal disminuye durante el ayuno en los prematuros [19]. Los enfoques actuales de alimentación durante la transfusión de glóbulos rojos varían y se basan en la opinión de expertos en lugar de evidencia sólida [20, 21].
Este estudio es el primero en comparar los dos enfoques de alimentación diferentes durante la transfusión en un diseño prospectivo aleatorizado y controlado. Las limitaciones de este estudio incluyen la falta de análisis de marcadores de perfusión intestinal tales como NIRS o de lesión de la mucosa, tal como análisis de sangre oculta o proteína de unión a ácidos grasos intestinales [22, 23]. Otra limitación es el número de episodios de TRAGI más bajo de lo esperado durante el período de estudio (significativamente menor que otras tasas reportadas) [24]. Elegimos incluir solo neonatos MBPN , con alimentación completa , estables hemodinámicamente, ya que estos son los neonatos en los cuales TRAGI se ha reportado con mayor frecuencia [2, 25]. Los estudios controlados randomizados como éste, incluso si tienen poca potencia, son útiles para realizar cálculos de tamaño de muestra para estudios más grandes y definitivos. Según este estudio, sería necesario un tamaño de muestra de 309 eventos para ambos grupos de NPO y FED para encontrar una disminución estadísticamente significativa en NEC con la suspensión de alimentos.
Existe una creciente conciencia de que la
exposición a una transfusión de glóbulos rojos en los primeros 28 días de vida
está asociada con la mortalidad intrahospitalaria [26]. Sorprendentemente,
aunque todos los neonatos en ambos grupos recibieron transfusiones, hubo una
tendencia hacia una mayor mortalidad en el grupo FED. Se especula que los
glóbulos rojos pueden modular directamente la función de las células inmunes del
huésped, una vía denominada inmunomodulación relacionada con la transfusión (TRIM)
que puede ser el mecanismo subyacente del aumento de los outcomes adversos
tales como NEC, DBP, ROP y mortalidad [26]. La asociación entre el régimen de
alimentación durante la transfusión y los outcomes adversos no son
concluyentes y se pueden encontrar por coincidencia en este estudio.
Hay algunas limitaciones en este estudio.
Primero, el equipo tratante y el equipo del estudio no estaban cegados a
los brazos de asignación. Esto puede tener un efecto en la interpretación de
algunos hallazgos clínicos como la distensión abdominal. Pero para evitar el
sesgo, tratamos de hacer definiciones lo más objetivas posibles y agregar
algunas medidas, como la circunferencia abdominal. Además, aún se necesitan
mejores medios para diagnosticar y definir NEC. El sistema de estadificación de
Bell tiene cierta subjetividad en algunos puntos y su adecuación para definir
casos de NEC ha sido un tema de controversia durante algún tiempo, sin embargo,
actualmente es el sistema de clasificación más utilizado [27].
En conclusión, aunque los datos actuales recomiendan
fuertemente suspender
la alimentación durante la transfusión, ésto queda por ser demostrado con estudios
controlados randomizados. Los resultados del presente estudio sugieren que existe una falta de
beneficio para disminuir las tasas de NEC del ayuno durante un período de 8-12
horas en prematuros de MBPN durante la transfusión. Dado que el régimen de
alimentación durante las transfusiones sigue siendo controvertido, un estudio
multicéntrico más grande con un diseño similar que incluya marcadores de
perfusión y lesión intestinal sería de gran valor.
Referencias
-
Blau J, Calo JM, Dozor D, et al. Transfusion-related acute gut injury: necrotizing enterocolitis in very low birth weight neonates after packed red blood cell transfusion. J Pediatr. 2011; 158(3):403–409.
-
Krimmel GA, Baker R, Yanowitz TD. Blood transfusion alters the superior mesenteric artery blood flow velocity response to feeding in premature infants. Am J Perinatol. 2009; 26(2):99–105.
-
Mohamed A, Shah PS. Transfusion associated necrotizing enterocolitis: a meta-analysis of observational data. Pediatrics. 2012; 129(3):529–540.
-
DeRienzo C, Smith PB, Tanaka D, et al. Feeding practices and other risk factors for developing transfusion-associated necrotizing enterocolitis. Early Hum Dev 2014;90(5):237–240.
-
Doty M, Wade C, Farr J, et al. Feeding during Blood Transfusions and the Association with Necrotizing Enterocolitis.Am J Perinatol. 2016 Jul;33(9):882-6.
-
Patel RM, Knezevic A, Shenvi N, et al. Association of red blood cell transfusion, anemia, and necrotizing enterocolitis in very low-birth-weight infants. JAMA. 2016 Mar 1;315(9):889-97.
-
Singh R, Visintainer PF, Frantz ID 3rd, et al. Association of necrotizing enterocolitis with anemia and packed red blood cell transfusions in preterm infants. J Perinatol. 2011; 31(3):176–182.
-
Jasani B, Rao S, Patole S. Withholding Feeds and Transfusion-Associated Necrotizing Enterocolitis in Preterm Infants: A Systematic Review. AdvNutr. 2017 Sep 15;8(5):764-769
-
Nickel RS, Josephson CD. Neonatal Transfusion Medicine: Five Major Unanswered Research Questions for the Twenty-First Century. ClinPerinatol. 2015 Sep;42(3):499-513.
-
Bednarek FJ, Weisberger S, Richardson DK, et al. Variations in blood transfusions among newborn intensive care units. SNAP II Study Group. J Pediatr. 1998; 133(5):601–607.
-
Hyung N, Campwala I, Boskovic DS, et al. The relationship of red blood cell transfusion to intestinal mucosal injury in premature infants. J Pediatr Surg. 2016 Nov 6.
-
Stritzke AI, Smyth J, Synnes A, Lee SK, Shah PS. Transfusion-associated necrotising enterocolitis in neonates. Arch Dis Child Fetal Neonatal Ed. 2013 Jan;98(1):F10-4.
-
Patel RM, Kandefer S, Walsh MC, Bell EF, Carlo WA, Laptook AR, Sánchez PJ, Shankaran S, Van Meurs KP, Ball MB, Hale EC, Newman NS, Das A, Higgins
RD, Stoll BJ; Eunice Kennedy Shriver National Institute of Child Health and Human Development Neonatal Research Network. Causes and timing of death in extremely premature infants from 2000 through 2011. N Engl J Med. 2015 Jan 22;372(4):331-40. -
Lieberman JMSJ, Marks C, Marks WH. Human intestinal fatty acid binding protein : report of an assay with studies in normal volunteers and intestinal ischemia. Surgery 1997;121:335–42.
-
Kanmaz HG, Sarikabadayi YU, Canpolat E, et al. Effects of red cell transfusion on cardiac output and perfusion index in preterm infants. Early Hum Dev. 2013
Sep;89(9):683-6. -
Maheshwari A, Patel RM, Christensen RD. Anemia, red blood cell transfusions, and necrotizing enterocolitis. SeminPediatr Surg. 2018 Feb;27(1):47-51.
-
Quigley M, McGuire W. Formula versus donor breast milk for feeding preterm or low birth weight infants. Cochrane Database Syst Rev. 2014 Apr 22;(4):CD002971.
-
Jasani B, Patole S. Standardized feeding regimen for reducing necrotizing enterocolitis in preterm infants: an updated systematic review. J Perinatol. 2017
Jul;37(7):827-833. -
Leidig E. Doppler analysis of superior mesenteric artery blood flow in preterm infants. Arch Dis Child. 1989 Apr;64(4 Spec No):476-80.
-
Hilditch C, Keir A.Do feeding practices during transfusion influence the risk of developing necrotising enterocolitis in preterm infants?J Paediatr Child Health. 2018 May;54(5):582-584. doi: 10.1111/jpc.13880
-
El-Dib M, Narang S, Lee E, et al. Red blood cell transfusion, feeding and necrotizing enterocolitis in preterm infants. J Perinatol 2011;31(3):183–187.
-
Chessex P, Watson C, Kaczala GW, et al. Determinants of oxidant stress in extremely low birth weight premature infants. Free RadicBiol Med. 2010 Nov 15;49(9):1380-6.
-
Kanmaz HG, Sarikabadayi YU, Canpolat E, et al. Effects of red cell transfusion on cardiac output and perfusion index in preterm infants. Early Hum Dev. 2013
Sep;89(9):683-6. -
Demirel G, Celik IH, Aksoy HT, et al. Transfusion-associated necrotising enterocolitis in very low birth weight premature infants. Transfus Med. 2012 Oct;22(5):332-7.
-
Christensen RD, Lambert DK, Henry E, et al. Is "transfusionassociated necrotizing enterocolitis" an authentic pathogenic entity?Transfusion. 2010 May;50(5):1106-12.
-
Mally P, Golombek SG, Mishra R, et al. Association of necrotizing enterocolitis with elective packed red blood cell transfusions in stable, growing, premature neonates. Am J Perinatol. 2006; 23(8):451-8.
-
Crawford TM, Andersen CC, Hodyl NA, Robertson SA, Stark MJ. The contribution of red blood cell transfusion to neonatal morbidity and mortality.J Paediatr Child Health. 2019 Feb 8. doi: 10.1111/jpc.14402
-
Gephart SM, Gordon PV, Penn AH, et al. Changing the paradigm of defining, detecting, and diagnosing NEC: Perspectives on Bell's stages and biomarkers for NEC.Semin Pediatr Surg. 2018 Feb;27(1):3-10.