Fentanyl y Oxigenación cerebral
Febrero 2021
Efecto de bolos de Fentanilo en Oxigenación cerebral y Hemodinamia en prematuros : estudio observacional prospectivo
Souvik Mitra Division of Neonatal-Perinatal Medicine, Dalhousie University , Halifax, Canada Neonatology Febrero 2021
Introducción
La autorregulación cerebral es
un mecanismo fisiológico que limita la variación del flujo sanguíneo
cerebral en un rango de presiones de perfusión cerebral y es un proceso
clave para asegurar una perfusión y oxigenación adecuadas del cerebro
[1]. El deterioro de la autorregulación cerebral relacionado con la
prematuridad hace que el cerebro prematuro sea vulnerable a los cambios
en la presión arterial y las alteraciones hemodinámicas [2]. Por lo
tanto, los cambios hemodinámicos sutiles inducidos por medicamentos u
otros procedimientos podrían potenciar la hipoxia cerebral y la lesión
isquémica en el cerebro prematuro. El fentanilo, un analgésico opioide,
es uno de esos medicamentos que se utiliza comúnmente para el control
del dolor y la sedación en la unidad de cuidados intensivos neonatales (UCIN)
[3].
Se ha postulado que los analgésicos opioides afectan el gasto cardíaco y
la presión arterial sistémica, causando alteraciones en el flujo
sanguíneo cerebral y la saturación de oxígeno. Varios estudios en niños
mayores han asociado el uso de fentanilo con la alteración en la presión
de perfusión cerebral [4, 5]. De Nadal et al. [5] propuso que la
alteración en la presión de perfusión cerebral después de la infusión de
fentanilo podría ser provocada por su acción vasodilatadora. En un
estudio de modelo animal usando monos rhesus no anestesiados, Nussmeier
et al. [6] han demostrado que los bolos de fentanilo están asociados con
una reducción significativa en el gasto cardíaco. En un estudio similar
con lechones recién nacidos, se encontró que la infusión continua de
fentanilo reduce el índice de oxigenación cerebral a lo largo del
tiempo, alcanzando una significación estadística al final de la infusión
(alrededor de 90 min) [7]
Un estudio piloto reciente de observación que exploró los efectos de la premedicación con atropina, un agente opioide (fentanilo o morfina) y cisatracurio antes de la intubación endotraqueal no emergente en prematuros y nacidos a término mostró que el 30% de los neonatos tenían una caída de la presión arterial en un 20 % o más, pero no hubo cambios asociados significativos en la saturación de oxígeno cerebral regional (RcSO2) o el gasto cardíaco. Sin embargo, el efecto del bolo de fentanilo solo sobre la perfusión cerebral en recién nacidos prematuros aún no se ha explorado [8].
Por lo tanto, el objetivo de los autores del presente trabajo fue explorar si en los recién nacidos prematuros (nacidos < 37 semanas de edad gestacional), una dosis en bolo estándar de fentanilo altera la RcSO2, la extracción de oxígeno tisular fraccional cerebral (cFTOE) y / o el gasto ventricular izquierdo (LVO) en comparación con línea de base previa a la administración.
Materiales y Métodos
Este fue un estudio observacional prospectivo realizado en la UCIN del IWK Health Center, una UCIN de atención terciaria en Halifax, Nueva Escocia, Canadá, de septiembre de 2017 a febrero de 2019.
Población del estudio
Los recién nacidos con < 37
semanas de gestación, ingresados en la UCIN y programados para recibir
una dosis en bolo de fentanilo para el dolor y sedación durante el
procedimiento (tal como la inserción de un catéter central insertado
periféricamente e intubación endotraqueal) fueron elegibles para
el estudio. Los siguientes grupos de neonatos fueron excluidos del
estudio: (i) bebés con anomalías cromosómicas o congénitas importantes;
(ii) si hubo necesidad de administrar el medicamento con urgencia (sin
permitir al menos 15 minutos de registro basal de datos premedicación)
según lo determinado por el team tratante; (iii) neonatos que habían
recibido fentanilo en las últimas 48 h; (iv) neonatos programados
para recibir indometacina, ibuprofeno y citrato de cafeína durante el
período de estudio (dentro de las 6 h siguientes a la administración de
fentanilo); (v) neonatos que tuvieron cirugía en las últimas 48 h; (vi)
neonatos considerados hemodinámicamente inestables por el equipo médico
tratante.
Una dosis en bolo de fentanilo se definió como fentanilo intravenoso de
1 a 2 μg / kg / dosis de acuerdo con la política institucional sobre
bolo de fentanilo para el dolor de procedimientos en recién nacidos
prematuros. Se prefirió específicamente una dosis de 1 μg / kg para los
recién nacidos prematuros no intubados [9, 10].
Procedimiento del estudio
El procedimiento del estudio se describe en la Figura 1. Un asistente de investigación se acercó a los padres de los prematuros elegibles de la UCIN, que se esperaba que recibieran un bolo de fentanilo de acuerdo con su médico tratante, para obtener su consentimiento informado. Una vez que tanto el estudio como el equipo médico tratante consideraron elegible para enrolamiento a un paciente con consentimiento, se instaló un monitor de espectroscopia de infrarrojo cercano (NIRS) INVOS 5100c con sensores neonatales junto a la cama para un control continuo de la oxigenación cerebral aproximadamente 30 - 45 minutos antes a la administración de medicamentos programada. Al mismo tiempo, también se instaló junto a la cama un dispositivo de monitorización Doppler de onda continua no invasivo, el Monitor Ultrasónico de Gasto cardíaco (USCOMTM; USCOM Ltd, Coffs Harbour, NSW, Australia). Todas las mediciones se realizaron con el neonato en una incubadora servocontrolada.
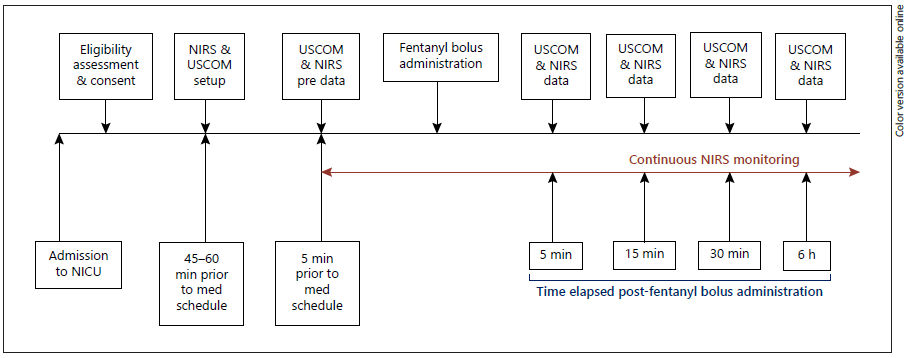
Figura 1.- Flujograma del estudio
Recolección de datos
Oximetría cerebral
Los datos basales se obtuvieron durante al menos 5 min antes de la administración del medicamento según el algoritmo del estudio (Figura 1). Se colocó un sensor NIRS en la región frontoparietal izquierda / derecha de la frente para la medición de RcSO2. La oximetría cerebral fue registrada por el dispositivo NIRS a una tasa de muestreo de 0.4 Hz durante un período de 6 h. Durante este período, se controlaron los parámetros fisiológicos estándar mediante un monitor de paciente (IntelliVue MX800; Philips, Países Bajos) : saturación de oxígeno arterial periférico (SpO2) mediante una sonda de pulsioximetría, presión arterial no invasiva mediante técnica oscilométrica automatizada, frecuencia cardíaca mediante electrodos de gel y frecuencia respiratoria mediante neumografía de impedancia torácica según el protocolo estándar de la UCIN. Los datos del INVOS 5100c se vincularon al monitor Philips Intellivue MX800 utilizando el módulo Intellibridge (PhilipsTM) en tiempo real. Al final del período de monitoreo de 6 horas, se retiraron los sensores y se revisaron los sitios para detectar cualquier daño en la piel. Posteriormente, los datos de RcSO2, SpO2, frecuencia cardíaca y frecuencia respiratoria se descargaron en un dispositivo de almacenamiento seguro.
Gasto ventricular izquierdo (LVO)
El monitor ultrasónico de gasto
cardíaco (USCOM) se utilizó para medir el LVO [11]. El perfil de flujo
Doppler para obtener el LVO se obtuvo colocando el transductor en el
tórax en la posición supraesternal derecha para medir el flujo sanguíneo
transaórtico. Se obtuvieron al menos cinco perfiles adecuados para
calcular un valor promedio para LVO. El software incorporado
describió el perfil de flujo Doppler de LVO con un método de pantalla
táctil poligonal de 5 puntos y calculó su área para calcular la integral
de tiempo de velocidad (VTI). El volumen stroke o sistólico (VS) se
calculó a partir de la ecuación VS = VTI × CSA, donde
CSA es el área de sección transversal de la válvula aórtica (calculada
por la USCOM a partir de la longitud y el peso del neonato mediante las
ecuaciones de Nidorf) [12]. Al definir el intervalo entre perfiles
consecutivos, la frecuencia cardíaca se derivó y el LVO fue calculado
por el software USCOM a partir de un promedio de al menos cinco perfiles
(LVO = VS ventricular izquierdo × frecuencia cardiaca) [11].
El LVO se midió 5 min antes y 5, 15, 30 min y 6 h después de la
administración de fentanilo. Elegimos estos puntos de tiempo en función
del pico de acción del fentanilo en los recién nacidos (5 - 15 min),
mientras que la vida media de eliminación varía entre 6 y 32 h [13].
Outcomes
El Outcome Primario fue la diferencia entre el RcSO2 medido 5 minutos antes y el RcSO2 medido en puntos de tiempo preespecificados después de la administración de fentanilo.
Los Outcomes Secundarios incluyeron las diferencias entre cFTOE, LVO y otros parámetros fisiológicos (SpO2, frecuencia cardíaca y frecuencia respiratoria) medidos 5 minutos antes y en puntos de tiempo preespecificados después de la administración de fentanilo.
Los datos demográficos, incluidas las variables prenatales, perinatales y neonatales, se registraron de los registros maternos y de la UCIN de cada sujeto inscrito.
Organización y Análisis de los datos
Los datos del monitor NIRS se
analizaron inicialmente utilizando la versión sin conexión de la
herramienta de análisis del sistema de monitorización INVOSTM. Antes del
análisis, los artefactos se eliminaron manualmente. Los artefactos se
definieron como: cambios en RcSO2 que no podían explicarse
fisiológicamente o cambios que iban acompañados de una distorsión severa
en los otros parámetros que sugerían movimiento o manipulación del bebé
[14].
La extracción de oxígeno tisular fraccional (FTOE) se calculó mediante la fórmula: (SpO2 - RcSO2) / SpO2 [14].
Análisis estadístico
Los datos demográficos de todos los sujetos del estudio se resumieron mediante estadística descriptiva. Todas las variables continuas se expresaron como promedios (± desviación estándar [± DE]), mientras que las variables categóricas se expresaron como porcentajes. Con cada neonato actuando como su propio control, se realizaron análisis comparativos para los valores anteriores y posteriores al fentanilo para todos los outcomes utilizando análisis de varianza de medidas repetidas (ANOVA). Se consideró estadísticamente significativo un valor de p < 0,05.
Cálculo del tamaño muestral
El tamaño muestral se basó en
el Outcome primario de interés. Se han realizado estudios limitados que
han documentado medidas de tendencia central y dispersión para RcSO2 en
recién nacidos prematuros [14, 15]. En un estudio reciente, Alderliesten
et al. publicaron datos normativos para RcSO2 en una cohorte de 999
recién nacidos prematuros con un perfil demográfico similar al de
nuestra población de la UCIN [14]. Basado en un α de 0.05, potencia
establecida en 80% y un rango reportado de promedios de RcSO2 entre 62 -
71% con una SD de 7%, estimamos que para demostrar un cambio de 1
DE en RcSO2 usando ANOVA unidireccional por pares (4 comparaciones por
pares), igualdad de 2 colas, se necesitarían 23 bebés [14, 16].
Suponiendo una tasa de abandono del 20% debido a fallas logísticas y
retiro del consentimiento, determinamos un tamaño de muestra final de 28
neonatos.
Resultados
Se enrolaron en el estudio 28
neonatos con una edad gestacional media de 28 semanas (rango
intercuartílico [IQR] 25-29 semanas) y un peso medio al nacer de 1.035 g
(IQR 830-1.292 g). Todos los bebés enrolados recibieron una dosis
intravenosa mediana de fentanilo administrada en forma de bolo durante 1
minuto de 1 μg / kg (IQR 1–1,7 μg / kg) antes de la colocación de un
catéter venoso central insertado periféricamente. Ninguno de los
infantes recibió una infusión continua de fentanilo durante o después
del bolo. Diez de los 28 lactantes (mediana de EG 25 semanas [IQR 23-29
semanas]; mediana de peso al nacer 820 g [IQR 655-1,380 g]) estaban en
ventilación mecánica (6 con oscilación de alta frecuencia; 4 con
ventilación mecánica convencional) , 13 estaban con asistencia
respiratoria no invasiva (11 con presión positiva nasal continua en las
vías respiratorias; 2 con ventilación con presión positiva intermitente
nasal) y los 5 neonatos restantes no tenían asistencia respiratoria en
el momento del estudio. La mediana de edad posnatal en el momento del
estudio era de 4 días (IQR 3-7 días). El flujo de pacientes se
representa en la Figura 2.
La Tabla 1
presenta las características basales de los niños enrolados.
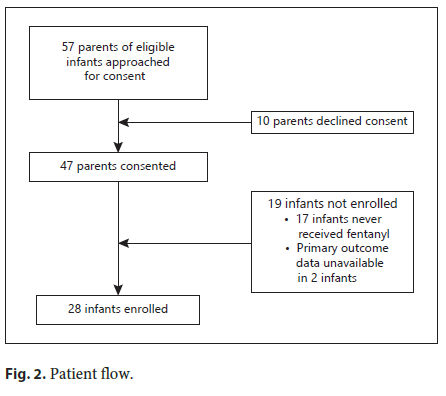
Figura 2.- Flujo de pacientes
Tabla 1.- Características basales de los neonatos incluídos
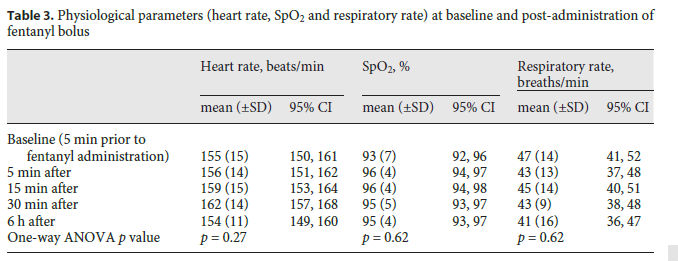
Los valores medios (± DE) de RcSO2, cFTOE y LVO 5 min antes del bolo de fentanilo fueron 73.6 (± 11.8)%, 21,9 (± 11,2) y 380 (± 147) ml / kg / min, respectivamente. El ANOVA de una vía no demostró diferencias significativas entre las medidas prefentanilo y posfentanilo para ninguno de los valores de RcSO2, cFTOE y LVO (Tabla 2; Figura 3). Las pruebas post hoc con la prueba de comparación múltiple de Tukey no mostraron diferencias significativas entre los valores anteriores y posteriores a la medicación. El análisis de sensibilidad que incluyó sólo a los lactantes que estaban en ventilación mecánica en el momento del estudio también arrojó resultados similares (valor p de ANOVA de una vía para los 3 parámetros > 0,05). No se demostraron diferencias significativas entre las medidas pre-fentanilo y post-fentanilo de otros parámetros fisiológicos tales como frecuencia cardíaca, SpO2 y frecuencia respiratoria (Tabla 3).
Tabla 2.- Valores de RcSO2, cFTOE y LVO a nivel basal y post-administración de bolos de Fentanilo
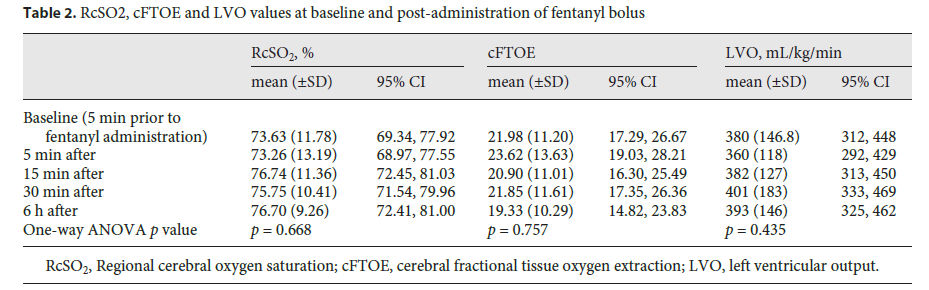
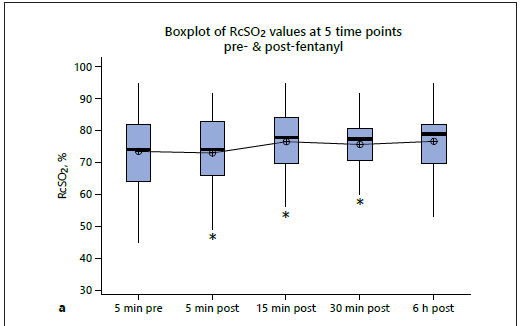
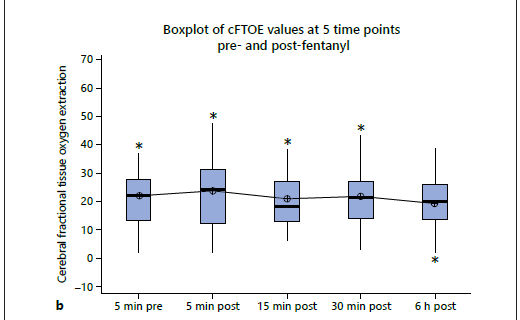
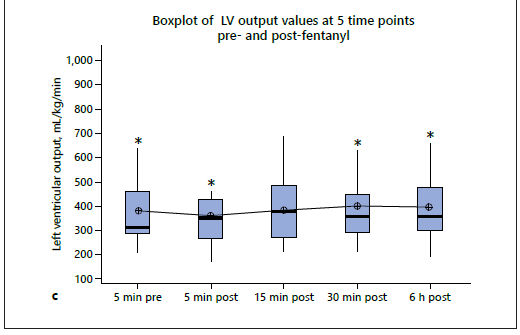
Figura 3.- a) Diagrama de valores de RcSO2 en 5 puntos de tiempo antes y después de la administración de fentanilo. b)Diagrama de caja de valores de cFTOE en 5 puntos de tiempo antes y después de la administración de fentanilo. c) Diagrama de caja de los valores de Gasto de VI en 5 momentos antes y después de la administración de fentanilo.
Tabla 3.- Parámetros fisiológicos (Frecuencia cardíaca, SpO2 y frecuencia respiratiria) basales y post-administración de bolos de fentanyl
Discusión
En este estudio observacional
prospectivo, los autores demuestran que la administración de una dosis
en bolo de fentanilo de 1 a 2 μg / kg / min no alteró significativamente
la oxigenación cerebral regional, la extracción de oxígeno del tejido
cerebral regional y el Gasto cardíaco de ventrículo izquierdo en
neonatos muy prematuros hemodinámicamente estables. Existe una
preocupación creciente por el vínculo entre el uso de fentanilo y los
resultados deficientes del desarrollo neurológico en los bebés
prematuros. En un estudio observacional reciente, McPherson et al. [17]
encontró que la dosis acumulada de fentanilo en recién nacidos
prematuros se correlacionó significativamente con la reducción del
diámetro cerebeloso transversal (r = 0,461, p = 0,002). En otro estudio,
Lammers et al. [18] encontró que hubo una disminución significativa en
el score de habilidades motoras entre recién nacidos prematuros que
recibieron fentanilo en dosis altas versus dosis bajas / sin dosis (p =
0.026). Por lo tanto, la alteración de la perfusión cerebral, ya sea
directa o indirectamente, mediada a través de la alteración del gasto
cardíaco, puede ser un factor que contribuya a tales hallazgos
epidemiológicos. Sin embargo, en este estudio no pudimos demostrar
ningún efecto significativo de una sola dosis en bolo de fentanilo sobre
la oxigenación cerebral o la hemodinámica.
El uso de medicamentos no aprobados (off-label) es un problema muy poco
reconocido en el cuidado neonatal. En un estudio observacional reciente,
Schweigertova et al. [19] mostró que 88.6% de los recién nacidos de
cualquier edad gestacional, ingresados a UCIN, reciben al menos un
fármaco off - label o no autorizado durante su estadía en UCIN. El
número es aún más asombroso en prematuros extremos (< 28 semanas de
gestación), donde el 99.5% de los ingresados a UCIN están expuestos a
uno o más medicamentos off - label o no autorizados durante su estadía
[20]. Medicamentos off-label como fentanilo, paracetamol ,
furosemida, heparina, propranolol, sildenafil y espironolactona han
encontrado su camino en el uso regular en la UCIN con beneficios
tangibles a corto plazo [20]. Sin embargo, la seguridad y eficacia de
tales medicamentos se han extrapolado en gran medida de estudios en
adultos. Con la creciente disponibilidad de tecnologías no invasivas
como NIRS, los investigadores están explorando cada vez más los efectos
de diferentes medicamentos off - label sobre la oxigenación cerebral en
los bebés prematuros ingresados en la UCIN. Se han utilizado con éxito
estudios similares que utilizan mediciones de RcSO2 para evaluar el
efecto de otros fármacos como la morfina, midazolam, indometacina,
ibuprofeno, paracetamol y cafeína sobre la oxigenación cerebral en
prematuros [21-24]. Tales estudios han llevado a los RCTs a explorar
regímenes de infusión más seguros para indometacina e ibuprofeno en
recién nacidos prematuros [25, 26].
Recientemente se ha explorado el
efecto de un protocolo de premedicación que incluye fentanilo como uno
de los tres medicamentos administrados antes de una intubación
endotraqueal no emergente sobre el RcSO2 y el gasto cardíaco en recién
nacidos a término y prematuros [8]. Sin embargo, hasta donde sabemos,
este es el primer estudio que explora los efectos de un bolo único de
fentanilo intravenoso sobre la oxigenación cerebral y la hemodinamia en
prematuros. La medición de saturación de oxígeno regional
utilizando un dispositivo NIRS se ha utilizado como sustituto de la
oxigenación cerebral regional. Ha sido demostrado por Caicedo et al.
[27] que las alteraciones en la autorregulación cerebral medidas
mediante NIRS se correlacionan con los outcomes clínicos a largo plazo
utilizando los scores de Bayley y Griffith a los 12 y 24 meses de edad
gestacional corregida. En comparación con la oximetría de pulso que solo
proporciona una medida de la saturación de oxígeno arterial restando el
flujo no pulsátil, NIRS proporciona un promedio ponderado de las señales
de saturación de oxígeno de las arteriolas, vénulas y capilares.
Es por eso que la saturación de oxígeno regional derivada de NIRS (RSO2)
refleja un balance del suministro y demanda de oxígeno tisular local,
cuantificado por el FTOE [28]. En nuestro estudio, pudimos determinar
con precisión el cFTOE marcando el tiempo de los valores de RcSO2 y SpO2.
Esto se logró enlazando en tiempo real los datos de RcSO2 desde el INVOS
5100c al monitor Philips Intellivue MX800 que registró la SpO2,
utilizando el módulo Intellibridge (PhilipsTM). Además, para la
evaluación hemodinámica, optamos por utilizar el dispositivo USCOMTM en
lugar de la ecocardiografía de cabecera tradicional. Esto se hizo para
minimizar la manipulación de los niños prematuros ya que se requirieron
múltiples evaluaciones en un corto período de tiempo. Aunque no probamos
la validez de las mediciones de USCOM en este estudio en particular, la
confiabilidad y validez de USCOMTM frente a la ecocardiografía
convencional se han probado satisfactoriamente en estudios neonatales
recientes [11, 29]
Hay varias limitaciones de este estudio.
En primer lugar, solo medimos los cambios fisiológicos a corto plazo de la oxigenación y perfusión cerebrales en lugar de las consecuencias clínicas de la medicación en este estudio. Reconocemos que el fentanilo puede ejercer sus efectos a través de varios mecanismos directos e indirectos, y estos mecanismos pueden ser difíciles de distinguir a través de tales estudios a corto plazo.
En segundo lugar, obtuvimos datos de solo 6 h, según los tiempos de acción máxima y la vida media de eliminación. Por lo tanto, cualquier efecto tardío del bolo de fentanilo sobre la oxigenación / perfusión cerebral, aunque improbable, no fue capturado en este estudio.
En tercer lugar, estimamos las diferencias de RcSO2, cFTOE y LVO en puntos de tiempo fijos después de la administración de fentanilo, como se menciona en los métodos. Por lo tanto, podríamos haber pasado por alto diferencias más sutiles que ocurren entre esos puntos de tiempo preespecificados.
Finalmente, se midió el efecto de una única dosis en bolo de fentanilo sobre la oxigenación cerebral en los recién nacidos prematuros en lugar de los efectos cerebrovasculares de la dosis acumulativa, que podría estar relacionada con los resultados adversos a largo plazo.
Conclusión
En resumen, nuestro estudio
muestra que la administración de fentanilo en bolos de 1 a 2 μg / kg /
min para el dolor y sedación durante el procedimiento en recién nacidos
muy prematuros estables no afecta la oxigenación cerebral, la extracción
de oxígeno del tejido cerebral y el gasto cardíaco en los recién nacidos
prematuros. Sin embargo, nos abstenemos de comentar sobre los efectos a
largo plazo de las dosis en bolo únicas o múltiples de fentanilo, así
como de la infusión de fentanilo, sobre los resultados del desarrollo
neurológico según los resultados de nuestro estudio.
Referencias
-
Lassen NA. Cerebral blood flow and oxygen consumption in man. Physiol Rev. 1959 Apr; 39(2): 183–238.
-
Wong FY, Leung TS, Austin T, Wilkinson M, Meek JH, Wyatt JS, et al. Impaired autoregulation in preterm infants identified by using spatially resolved spectroscopy. Pediatrics. 2008 Mar; 121(3):e604–11.
-
Hall RW, Shbarou RM. Drugs of choice for sedation and analgesia in the neonatal ICU. Clin Perinatol. 2009 Mar; 36(1): 15–26.
-
Hocker SE, Fogelson J, Rabinstein AA. Refractory intracranial hypertension due to fentanyl administration following closed head injury. Front Neurol. 2013 Jan; 4: 3.
-
de Nadal M, Ausina A, Sahuquillo J, Pedraza S, Garnacho A, Gancedo VA. Effects on intracranial pressure of fentanyl in severe head injured patients. Acta Neurochir Suppl (Wien). 1998; 71: 10–2.
-
Nussmeier NA, Benthuysen JL, Steffey EP, Anderson JH, Carstens EE, Eisele JH Jr, et al. Cardiovascular, respiratory, and analgesic effects of fentanyl in unanesthetized rhesus monkeys. Anesth Analg. 1991 Feb; 72(2): 221– 6.
-
Rey-Santano C, Mielgo V, Valls-I-Soler A, Encinas E, Lukas JC, Vozmediano V, et al. Evaluation of fentanyl disposition and effects in newborn piglets as an experimental model for human neonates. PLoS One. 2014 Mar; 9(3):e90728.
-
Truong L, Kim JH, Katheria AC, Finer NN, Marc-Aurele K. Haemodynamic effects of premedication for neonatal intubation: an observational study. Arch Dis Child Fetal Neonatal Ed. 2020 Mar; 105(2): 123–7.
-
Örge FH, Lee TJ, Walsh M, Gordon K. Comparison of fentanyl and morphine in laser surgery for retinopathy of prematurity. J AAPOS. 2013 Apr; 17(2): 135–9.
-
Kasirer Y, Shah V, Yoon EW, Bromiker R, Mcnair C, Taddio A. Safety of fentanyl for peripherally inserted central catheter in non-intubated infants in the neonatal intensive care unit. J Perinatol. 2018 May; 38(5): 526–9.
-
Meyer S, Todd D, Shadboldt B. Assessment of portable continuous wave Doppler ultrasound (ultrasonic cardiac output monitor) for cardiac output measurements in neonates. J Paediatr Child Health. 2009 Jul-Aug; 45(7-8): 464–8.
-
Nidorf SM, Picard MH, Triulzi MO, Thomas JD, Newell J, King ME, et al. New perspectives in the assessment of cardiac chamber dimensions during development and adulthood. J Am Coll Cardiol. 1992 Apr; 19(5): 983–8.
-
Ackland District Health Board. NW Newborn Drug Protocol - Fentanyl Pharmacology [Internet]. 2004 [cited 2020 Feb 27]. Available from http://www.adhb.govt.nz/newborn/drugprotocols/FentanylPharmacology.htm
-
Alderliesten T, Dix L, Baerts W, Caicedo A, van Huffel S, Naulaers G, et al. Reference values of regional cerebral oxygen saturation during the first 3 days of life in preterm neonates. Pediatr Res. 2016 Jan; 79(1–1): 55–64.
-
Pichler G, Binder C, Avian A, Beckenbach E, Schmölzer GM, Urlesberger B. Reference ranges for regional cerebral tissue oxygen saturation and fractional oxygen extraction in neonates during immediate transition after birth. J Pediatr. 2013 Dec; 163(6): 1558–63.
-
Shao J, Chow SC, Wang H. Sample Size Calculations in Clinical Research. 2nd ed. Boca Raton: CRC Press; 2003.
-
McPherson C, Haslam M, Pineda R, Rogers C, Neil JJ, Inder TE. Brain Injury and Development in Preterm Infants Exposed to Fentanyl. Ann Pharmacother. 2015 Dec; 49(12): 1291–7.
-
Lammers EM, Johnson PN, Ernst KD, Hagemann TM, Lawrence SM, Williams PK, et al. Association of fentanyl with neurodevelopmental outcomes in very-low-birth-weight infants. Ann Pharmacother. 2014 Mar; 48(3): 335–42.
-
Schweigertova J, Durisova A, Dolnikova D, Ondriasova E, Balazova M, Slezakova V, et al. Off-label and unlicensed use of medicinal products in the neonatal setting in the Slovak Republic. Pediatr Int (Roma). 2016 Feb; 58(2): 126–31.
-
de Souza AS Jr, Dos Santos DB, Rey LC, Medeiros MG, Vieira MG, Coelho HL. Off-label use and harmful potential of drugs in a NICU in Brazil: A descriptive study [Internet]. BMC Pediatr. 2016 Jan; 16(1): 13. [cited 2020 Feb Available from: https://www.ncbi.nlm. nih.gov/pmc/articles/PMC4722776/
-
van Alfen-van der Velden AA, Hopman JC, Klaessens JH, Feuth T, Sengers RC, Liem KD. Effects of midazolam and morphine on cerebral oxygenation and hemodynamics in ventilated premature infants. Biol Neonate. 2006; 90(3): 197–202.
-
Patel J, Roberts I, Azzopardi D, Hamilton P, Edwards AD. Randomized double-blind controlled trial comparing the effects of ibuprofen with indomethacin on cerebral hemodynamics in preterm infants with patent ductus arteriosus. Pediatr Res. 2000 Jan; 47(1): 36–42.
-
Dani C, Bertini G, Reali MF, Tronchin M, Wiechmann L, Martelli E, et al. Brain hemodynamic changes in preterm infants after maintenance dose caffeine and aminophylline treatment. Biol Neonate. 2000 Jul; 78(1): 27–32.
-
Dani C, Poggi C, Cianchi I, Corsini I, Vangi V, Pratesi S. Effect on cerebral oxygenation of paracetamol for patent ductus arteriosus in preterm infants. Eur J Pediatr. 2018 Apr; 177(4): 533–9.
-
Hammerman C, Shchors I, Jacobson S, Schimmel MS, Bromiker R, Kaplan M, et al. Ibuprofen versus continuous indomethacin in premature neonates with patent ductus arteriosus: is the difference in the mode of administration? Pediatr Res. 2008 Sep; 64(3): 291–7.
-
Lago P, Salvadori S, Opocher F, Ricato S, Chiandetti L, Frigo AC. Continuous infusion of ibuprofen for treatment of patent ductus arteriosus in very low birth weight infants. Neonatology. 2014; 105(1): 46–54.
-
Caicedo A, De Smet D, Vanderhaegen J, Naulaers G, Wolf M, Lemmers P, et al. Impaired cerebral autoregulation using near-infrared spectroscopy and its relation to clinical outcomes in premature infants. Adv Exp Med Biol. 2011; 701: 233–9.
-
Sood BG, McLaughlin K, Cortez J. Near-infrared spectroscopy: applications in neonates. Semin Fetal Neonatal Med. 2015 Jun; 20(3): 164–72.
-
Patel N, Dodsworth M, Mills JF. Cardiac output measurement in newborn infants using the ultrasonic cardiac output monitor: an assessment of agreement with conventional echocardiography, repeatability and new user experience. Arch Dis Child Fetal Neonatal Ed. 2011 May; 96(3):F206–11.