Mejora de calidad de Lesión renal aguda neonatal
Febrero 2021
Mejora de la calidad del cuidado de la lesión renal aguda neonatal : respuesta específica neonatal a la 22a conferencia de Iniciativa de Calidad de Enfermedades Agudas (ADQI)
Matthew W. Harer
Division of Nephrology, Dialysis and Transplantation, Stead Family
Department of Pediatrics, University of Iowa, Iowa City, IA, USA
Journal of Perinatology (2021) 41:185–195 https://doi.org/10.1038/s41372-020-00810-z
Introducción
La injuria o lesión
renal
aguda (IRA o AKI) es común en recién nacidos críticamente enfermos y
se asocia con outcomes adversos que incluyen mortalidad y múltiples
medidas de morbilidad [1-11]. El impacto de la IRA neonatal sobre la
función renal a largo plazo aún se está dilucidando, pero los
estudios sugieren que la IRA incurre en un riesgo superior al de
otros factores de riesgo conocidos de enfermedad renal crónica (ERC)
[12-22]. A pesar de estas asociaciones, faltan vías de cuidado,
métricas / indicadores estándar de calidad y estrategias diseñadas
para optimizar el cuidado de IRA en recién nacidos [23, 24].
La 22a conferencia
de Iniciativa de Calidad de Enfermedades Agudas (ADQI) se convocó
para proporcionar un marco para la mejora de la atención en adultos
con riesgo de IRA. Este grupo identificó las mejores prácticas en
“prevención, identificación y cuidado de pacientes con AKI” en todo
el espectro de entornos de cuidado de salud. Sus recomendaciones
integrales se publicaron en 2019 [25-27], proporcionando una guía
muy necesaria para respaldar la prestación de cuidado de alta
calidad para IRA. Más importante aún, destacó el papel que tienen
los esfuerzos de mejora de la calidad en la atención de los
pacientes con riesgo de IRA y con IRA.
Aunque muchas de las recomendaciones de la ADQI 22 se pueden aplicar directamente a recién nacidos, existen aspectos únicos de fisiología neonatal y procesos de cuidado que difieren de los de los adultos y requieren un enfoque matizado. Dado el éxito que han mostrado los procesos de mejora del cuidado de IRA en adultos, se convocó a un grupo multidisciplinario de clínicos de nefrología neonatal y pediátrica para proporcionar un contexto específico neonatal y comentarios a cada una de las declaraciones de consenso de la 22a ADQI. Recomendamos que estas Guías se apliquen no solo al período neonatal, sino que incluyan toda la hospitalización en la UCIN. El objetivo general de este reporte es alentar y permitir que los clínicos desarrollen un programa de salud renal significativo para la mejora de la calidad en su UCIN. La comprensión de las mejores estrategias para reducir las consecuencias a corto y largo plazo de la IRA en recién nacidos [28-30] a través de la mejora de la calidad debe estudiarse y compartirse en todo el mundo.
Estándares comunitarios de cuidado clínico
para IRA
Pregunta 1: ¿
Cuáles son las funciones y responsabilidades de los clínicos y
sistemas de cuidado de salud en el monitoreo y mitigación del riesgo
de IRA?
Declaración de consenso A : Los sistemas de cuidado y profesionales de salud deben identificar las poblaciones y pacientes en riesgo de IRA e implementar intervenciones de monitoreo y prevención para disminuir la incidencia de IRA.
Declaración de consenso B : Se debe considerar un conjunto mínimo de factores de riesgo de referencia y exposiciones agudas para la estratificación del riesgo de IRA.
Los pacientes neonatales (de 0 a 28 días de edad) pueden desarrollar AKI en la comunidad si nacen en domicilio o después del alta hospitalaria inicial.
A nivel comunitario, los cuidadores deben identificar los factores maternos y neonatales que se sabe que aumentan el riesgo de IRA neonatal.
Los factores maternos se pueden dividir en tres períodos de tiempo diferentes: período pregestacional, gestacional y periparto (tabla 1) [31].
En un análisis del estudio Assessment of Worldwide Acute Kidney Epidemiology in Neonates (AWAKEN), una cohorte observacional multinacional de 24 centros de neonatos ingresados entre el 1 de enero de 2014 y el 31 de marzo de 2014, que tenían < 14 días de edad y recibieron al menos 48 h de líquidos intravenosos, Charlton et al. encontraron que 21 % de los recién nacidos desarrollaron AKI durante la primera semana posnatal a una edad promedio de 2.8 días [5], lo que sugiere que los factores maternos y los eventos perinatales contribuyeron significativamente a AKI.
También encontraron que entre los bebés que cumplieron con los criterios del estudio y fueron admitidos en una UCIN de referencia, las probabilidades de ser outborn eran mayores que las de nacer inborn .
Tabla 1.- Maternal risk factors for neonatal AKI.
|
Pregestational |
Gestational |
Peripartum |
|
Socioeconomic factors |
In vitro fertilization |
Nephrotoxic medications |
|
Age |
Maternal nutrition |
Chorioamnionitis |
|
Body weight |
Alcohol consumption |
Abruption |
|
Environmental stress |
Smoking |
Cord prolapse |
|
Interpregnancy interval |
Hypertensive disorders |
Illicit drug use |
|
CKD |
Nephrotoxic medications |
Perinatal asphyxia |
|
Hypertension |
Fetal growth restriction |
|
|
|
Oligohydramnios and unexplained polyhydramnios |
|
Los dos mayores factores de
riesgo de IRA neonatal, el nacimiento prematuro y el bajo peso al
nacer, se encuentran en los tres períodos de tiempo [8]. Ambos
factores de riesgo aumentan el riesgo de IRA a través de una vía
común: nefrogénesis deteriorada y cantidad de nefronas reducida, lo que
causa función tubular renal alterada (asociada con desregulación de
balance hidroelectrolítico y
deshidratación)
y tasa de filtración glomerular baja (TFG) [31]. Ambos efectos
limitan la reserva renal que ayuda a mantener la TFG durante eventos
estresantes agudos como la incapacidad para alimentarse
adecuadamente y diarrea, las cuales pueden causar una
deshidratación significativa y causar AKI (IRA) , especialmente en
ambientes de escasos recursos. Otros factores de riesgo de IRA
comunes incluyen deshidratación en recién nacidos con alta pérdida
de agua insensible, ciertas combinaciones de medicamentos como
vancomicina y piperacilina-tazobactam y recién nacidos con shock por
hiperplasia suprarrenal o cardiopatía congénita. Esta no es una
lista exhaustiva de factores de riesgo, sino solo algunas
situaciones comunes en las que intervenciones, terapéutica y
screening pueden prevenir o cambiar el curso de la LRA.
El desarrollo de estrategias destinadas a mitigar los factores maternos que causan IRA neonatal antes del parto puede ser fundamental para mejorar los outcomes. Apoyamos las estrategias comunitarias en curso dirigidas a la prevención del parto prematuro y la restricción del crecimiento fetal, ya que éstos son los factores de riesgo más importantes para IRA neonatal. Es imperativo el conocimiento y la identificación temprana de la deshidratación en los recién nacidos que no se alimentan bien y / o tienen pérdidas excesivas de deposiciones. Las estrategias de prevención primaria deben dirigirse no solo a los neonatólogos y pediatras, sino también a los profesionales de medicina familiar, obstétricia y materno-fetal.
Pregunta 2: ¿ Cómo se deben monitorear las poblaciones de alto riesgo de IRA?
Declaración de consenso A : Las poblaciones / pacientes con alto riesgo de desarrollar IRA deben someterse a una Evaluación de Salud Renal (KHA o kidney health assessment ) al menos cada 12 meses para definir y modificar su perfil de riesgo de IRA.
Declaración de consenso B : Los pacientes de alto riesgo tienen otro KHA al menos 30 días antes Y nuevamente 2 a 3 días después de una exposición planificada que conlleva riesgo de IRA.
Declaración de consenso C : Los médicos deben revisar la KHA de un paciente inmediatamente después de una exposición aguda no planificada que conlleva riesgo de IRA.
Estas recomendaciones basadas en adultos sugieren que los pacientes en riesgo deben someterse a una Evaluación de Salud Renal (KHA) anualmente, y antes o durante una enfermedad / procedimiento que se sabe que conlleva un alto riesgo de IRA.
El grupo está de acuerdo en que una evaluación neonatal (nKHA) debe dirigirse a los recién nacidos con alto riesgo de IRA (Tabla 2). En cuanto al tiempo, siendo el período neonatal de 28 días, no se aplica la recomendación anual. Creemos que se debe realizar una nKHA de rutina dentro de las 48 horas posteriores al nacimiento en neonatos de alto riesgo. También sugerimos que los recién nacidos de alto riesgo se sometan a evaluaciones periódicas, semanalmente durante el primer mes y luego mensualmente hasta que el paciente esté listo para el alta.
El grupo está de acuerdo en que la evaluación nKHA debe realizarse antes de procedimientos de alto riesgo, cirugías y exposición a medicamentos nefrotóxicos que se sabe que están asociados con IRA (Tabla 3). Esta evaluación podría ayudar a determinar si se deben implementar las medidas preventivas apropiadas (ejemplo; hidratación antes de eventos de alto riesgo). El grupo está de acuerdo con la recomendación de los adultos de que se debe repetir la nKHA 48 a 72 h después de procedimientos de alto riesgo, cirugías, exposiciones y con mayor frecuencia según sea necesario. Un médico con la formación y el contexto adecuados debe revisar la nKHA inmediatamente después de realizarla en asociación con un evento de alto riesgo.
Tabla 2.- Neonatos de alto riesgo.
Population
Preterm birth <28 weeks
Small for gestational age
Birth weight <1500 grams
Congenital anomalies of the kidney or urinary tract (CAKUT)
Congenital heart disease
Undergoing cardiopulmonary bypass
Single ventricle physiology
History of heart transplant
Extracorporeal membrane oxygenation (ECMO)
Hypoxic-ischemic encephalopathy
High risk of dehydration
Unrepaired gastroschisis
Inherited cutaneous conditions
Tabla 3.- Procedimientos y estados de alto riesgo .
Procedimientos de alto riesgo
Cardiopulmonary bypass
Parto complejo (o inestabilidad hemodinámica durante parto)
ECMO
Radiologic studies and procedures utilizing iodinated contrast
Major surgical procedures (NEC, CDH repair and Cardiac repair)
Cancer treatment
Estados de alto riesgo
Deshidratación
At risk for sepsis or culture-positive sepsis
Necrotizing enterocolitis
Decreased oncotic pressure
Increased intra-abdominal pressure
Hypotension requiring vasopressors
High nephrotoxic medication exposure
Hemodynamically significant PDA
Los componentes de esta
evaluación fueron operacionalizados como ABCDD, que incluyen (1)
historial de AKI, (2) determinación de la presión arterial, (3)
medición de creatinina, (4) revisión de la lista de medicamentos y
(5) tira reactiva de orina. Aunque estamos de acuerdo en principio
con la KHA, sugerimos que la nKHA solo incluya : historial de AKI,
medición de la presión arterial según las guías de la Academia
Estadounidense de Pediatría (AAP) [32], medición de creatinina y
revisión de la lista de medicamentos (o evaluación ABCD,
Figura 1).
El grupo cree que el análisis de orina no debería ser obligatorio en
pacientes neonatales por razones tanto clínicas como biológicas.
Desde el punto de vista práctico , es difícil obtener una muestra
limpia en recién nacidos mediante la técnica de recolección de
bolsas y el muestreo. Desde el punto de vista biológico, muchos
neonatos prematuros y recién nacidos a término durante las primeras
semanas tienen tasas elevadas de proteinuria transitoria fisiológica
e incluso hematuria transitoria asintomática [33-35]. Aunque no
recomendamos el análisis de orina, la evaluación de la densidad
específica u osmolalidad de orina puede tener un papel en el
manejo de la IRA para determinar si el recién nacido puede
concentrar la orina, lo que puede ayudar a desarrollar una
estrategia de manejo de líquidos [36].
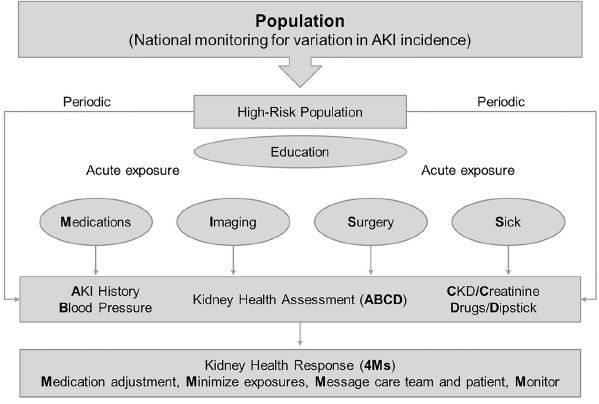
Figura 1 Evaluación ABCD y 4 letras Ms. KHA y respuesta. KHA incluye antecedentes de IRA, PA, ERC, nivel de creatinina sérica, lista de fármacos y tira reactiva de orina (ABCD). Las exposiciones incluyen medicamentos nefrotóxicos, imágenes, cirugía, enfermedad (NISS). KHR (4M) que abarca la revisión de la medicación para suspender medicamentos innecesarios, la minimización de las exposiciones nefrotóxicas, el envío de mensajes al equipo de atención médica y al paciente para alertar sobre el alto riesgo de AKI y el monitoreo de AKI y sus consecuencias. Reimpreso de Acute Disease Quality Initiative (ADQI) [25].
Pregunta 3: ¿ Cómo se pueden implementar las estrategias preventivas de IRA en poblaciones de alto riesgo ?
Declaración de consenso A. La KHA debe ir seguida por una Respuesta de Salud Renal (KHR) después de una exposición aguda a factores de riesgo de IRA.
Declaración de consenso B. Sugerimos crear conciencia sobre la definición, los signos, los síntomas y las exposiciones agudas asociadas con la IRA entre los médicos y los pacientes / poblaciones de alto riesgo.
Declaración de consenso C. Sugerimos una mayor coordinación entre todas las partes interesadas para monitorear la tasa, las causas y los outcomes de IRA para identificar las variaciones en el cuidado y los outcomes entre las poblaciones.
Estamos totalmente de acuerdo con estas estrategias para prevenir IRA en recién nacidos. El reporte de la 22a ADQI subraya el hecho de que la KHA es una instantánea del estado actual de la salud del riñón, y la valoración y evaluación de los cambios a lo largo del tiempo son invaluables para lograr una “respuesta de salud renal” (KHR) adecuada.
La KHR se centra en “las 4 M”
1) Ajuste de la medicación
2) Minimizar las exposiciones
3) Mensaje al equipo de atención y al paciente
4) Monitorear (Figura 1).
En ausencia de tratamientos probados para IRA establecida, las estrategias preventivas son la base del cuidado de IRA en los recién nacidos. Es muy necesario realizar esfuerzos multidisciplinarios coordinados para crear conciencia y educar a la comunidad de Cuidado Neonatal sobre los problemas relacionados con la IRA neonatal (definición, signos / síntomas, exposiciones de alto riesgo y poblaciones de alto riesgo). Proponemos que las asociaciones entre las comunidades de nefrología pediátrica y de neonatología (ej; Neonatal Kidney Collaborative www.babykidney.org) tendrán el mayor impacto en la educación de nuestra fuerza laboral.
La participación y el compromiso de los pediatras generales, neonatólogos hospitalistas, matronas o enfermeras neonatales, los asistentes médicos y los neonatólogos serán fundamentales para los esfuerzos diseñados para disminuir la carga de IRA. Además, a nivel individual, los nefrólogos pediátricos deben estar disponibles para consulta antes de procedimientos de alto riesgo en poblaciones de alto riesgo para optimizar la atención previa a la exposición.
Prevención primaria de AKI durante
hospitalización
Pregunta 1: ¿Cómo y cuándo se debe identificar el riesgo de IRA entre los pacientes hospitalizados?
Declaración de consenso A : Los pacientes al ingreso hospitalario deben ser evaluados para detectar el riesgo de IRA.
Declaración de consenso B : Todos los pacientes con riesgo de IRA deben tener al menos una evaluación de creatinina sérica, un análisis con tira reactiva de orina y una medición de diuresis.
Declaración de consenso C : Todos los pacientes hospitalizados deben tener una reevaluación periódica del riesgo utilizando modelos clínicos o electrónicos apropiados antes y después de la exposición al riesgo o cambio en el estado clínico.
Los recién nacidos ingresados en la UCIN que tienen factores de riesgo (Tablas 1 y 2) o están experimentando eventos que conllevan un riesgo adicional de AKI (Tabla 3), deben tener una evaluación inicial para AKI antes y luego evaluaciones repetidas a medida que el evento continúa (ej; enterocolitisnecrotizante (NEC) , tratamiento del ductus arterioso persistente (CAP) hemodinámicamente significativo).
Al igual que con cualquier enfermedad, el reconocimiento temprano y la implementación de estrategias de mitigación son fundamentales para mejorar los resultados.
Una cosa que es única en los recién nacidos es la duración de la hospitalización. Los recién nacidos pueden tener IRA en el momento del nacimiento o al ingreso a UCIN, pero siguen estando en riesgo de sufrir IRA durante una hospitalización que puede durar meses.
Por lo tanto, creemos que la identificación de eventos de alto riesgo, con una evaluación periódica de la LRA durante estos eventos, puede mejorar los resultados.
El desarrollo de sistemas de score de evaluación de riesgos sencillos y prácticos, similares a los desarrollados para niños y adultos, puede resultar útil [37-39].
Una adaptación reciente del programa de Lesiones Nefrotóxicas Negadas por Acción Justo a Tiempo (NINJA) ha sido eficaz para reducir las tasas de IRA en neonatos en la UCIN [40].
La incorporación de estos sistemas en la historia clínica electrónica (EMR) puede resultar beneficiosa. Durante los eventos de alto riesgo (Tabla 3), estamos de acuerdo con el reporte de la 22a ADQI de que se debe obtener una creatinina sérica (SCr) y monitorear la diuresis. Reconociendo los desafíos y riesgos de la extracción de sangre y la evaluación de la diuresis en los recién nacidos, un panel de expertos ha desarrollado un enfoque de consenso como parte de la planificación de un estudio observacional multicéntrico. Los investigadores de neonatología y nefrología de los 15 centros participantes han discutido, examinado y encontrado consenso sobre el estándar mínimo de cuidado para las evaluaciones de SCr / UOP en recién nacidos admitidos en la UCIN de la siguiente manera :
Durante la primera semana después del nacimiento, los recién nacidos que se espera que necesiten soporte respiratorio, soporte para la presión arterial o antibióticos intravenosos durante > 3 o más días, deben someterse a una evaluación de AKI (SCr y UOP) los días 2, 3 y 4 después del nacimiento.
La SCr y la UOP deben realizarse el día de y los 2 días siguientes a un evento de alto riesgo (procedimiento quirúrgico mayor, hipotensión que requiera vasopresores, DAP hemodinámicamente significativo, exposición nefrotóxica alta y pacientes con enterocolitis necrotizante).
La frecuencia de las evaluaciones debe adaptarse al paciente y la enfermedad individual y repetirse a medida que las condiciones cambian y el riesgo aumenta.
No estamos de acuerdo con la
recomendación del grupo ADQI de que se debe realizar un análisis de
orina durante todos los eventos de IRA neonatal de alto riesgo
debido a las preocupaciones sobre las altas tasas de falsos
positivos mencionadas anteriormente. Se debe considerar un análisis
de orina y otras pruebas en el escenario clínico apropiado (ej;
evaluación de infección del tracto urinario, evaluación de trombosis
de la vena renal) donde es probable que proporcione datos
accionables y / o ayude con el diagnóstico diferencial. El grupo de
ADQI no recomendó la tendencia del Balance hídrico , pero basándose
en la creciente evidencia sobre el impacto negativo de la sobrecarga
de líquidos en pacientes críticamente enfermos [2, 41], el grupo
recomienda fuertemente que todos los pacientes neonatales con riesgo
de IRA tengan una evaluación cuidadosa de su estado actual del
fluido. Particularmente en los recién nacidos, el uso de pesos
diarios para definir el balance de líquidos es una excelente
aproximación de la pérdida o ganancia neta de líquidos, consistente
con el trabajo publicado previamente en recién nacidos ≥ 36 semanas
de gestación [41]. Aprovechar la EMR para permitir el diagnóstico
oportuno de AKI es una oportunidad importante para mejorar la
entrega de cuidado , la evaluación de riesgos y la evaluación de AKI
neonatal. Los objetivos de estos sistemas de alerta no son solo
mejorar la conciencia del clínico tratante , sino también reducir la
gravedad y duración de la IRA. Los sistemas EMR han tenido éxito en
pacientes pediátricos [42-44], pero quedan por determinar los
beneficios de estas herramientas de alerta de AKI en recién nacidos.
Pregunta 2: ¿ Qué medidas preventivas básicas deberían considerarse un objetivo (Targets) para los proyectos de MC?
Declaración de consenso A : debe considerarse la corrección o mitigación temprana de los factores de riesgo de IRA modificables del contexto específico.
Estamos de acuerdo en que debe desarrollarse y probarse un paquete de cuidado (bundle) de IRA específico para recién nacidos con el objetivo de disminuir las tasas y la gravedad de la IRA.
Dicho paquete se centraría en la evaluación de riesgos, identificación de IRA en una etapa temprana del proceso de la enfermedad, mitigación de los factores de riesgo modificables, tratamiento de afecciones reversibles (ej; hipoperfusión renal, obstrucción de salida de vejiga) y la monitorización de complicaciones prevenibles (Tabla 4).
Reconocemos que pueden ser necesarias diferentes estrategias y paquetes para diferentes poblaciones de pacientes (ej; pacientes prematuros versus pacientes cardíacos) y escenarios clínicos (ej; exposición a medicamentos nefrotóxicos, hernia diafragmática congénita, bypass cardiopulmonar, oxigenación por membrana extracorpórea (ECMO) y ECN) .
Trabajar con equipos de subespecialidades que comprenden y pueden equilibrar los pros y los contras de las intervenciones en el contexto de la atención integral al paciente será esencial para el desarrollo y la implementación exitosa de dichos paquetes de atención neonatal.
Tabla 4.- Paquete AKI Neonatal
Evaluation of potentially modifiable risk and complications of AKI
Monitoring volume intake and output and daily weights
Calculate and track cumulative fluid overload
Evaluation of medications for nephrotoxic potential
Evaluation of underlying AKI cause/physiology
Treatment of hypoalbuminemia, hypotension, high abdominal pressure, hypoperfusion, bladder obstruction
Evaluation of nutrition/electrolyte composition of fluid intakes
Multidisciplinary approach: pharmacy, dietitian, bedside nurses
Pregunta 3: ¿Cuáles son los indicadores de calidad para evaluar el riesgo de IRA?
Declaración de consenso A : Los indicadores de calidad para la prevención de IRA en el hospital deben incluir (1) la proporción de pacientes con screening para riesgo de IRA, (2) proporción de pacientes identificados de alto riesgo de IRA, (3) proporción de exposiciones de alto riesgo de IRA entre toda la población hospitalizada y todos los pacientes de alto riesgo, (4) proporción de pacientes que recibieron una intervención adecuada en torno a una exposición de alto riesgo y (5) proporción de pacientes que desarrollaron IRA entre todos los ingresos.
Declaración de consenso B : Los indicadores de calidad deben revisarse y utilizarse para identificar áreas de mejora y acción.
Los autores creen que estas
declaraciones también se aplican a los recién nacidos. Las métricas
establecidas se pueden utilizar para monitorear las prácticas,
determinar la efectividad de las intervenciones, identificar puntos
de referencia o benchmarks para la atención y desarrollar objetivos de mejora de
la calidad institucional centrados en la reducción de IRA
neonatal. Utilizando estas métricas, múltiples estudios han
demostrado que los programas de vigilancia diseñados para
identificar y mitigar el riesgo en pacientes que reciben
medicamentos nefrotóxicos redujeron las tasas de IRA, redujeron los
costos y mejoraron los outcomes en niños y adultos [37-39, 45].
Como ejemplo, el proyecto Baby NINJA demostró una reducción
sostenida > 50% en las tasas de AKI luego de la implementación de un
proceso de MC. Es importante destacar que la reducción de AKI
mediante el proceso Baby NINJA QI solo se ha realizado en una UCIN
de nivel IV y debe validarse en otras UCIN. A partir de mayo de
2020, diez hospitales pediátricos ahora están utilizando estas
métricas para rastrear los esfuerzos de mejora de la calidad para
reducir la IRA neonatal asociada a medicamentos nefrotóxicos
adquirida en hospital como parte de las Soluciones
para Seguridad del Paciente colaborativa y dentro de la Colaboración Baby
NINJA. Estas métricas deben considerarse en otros recién nacidos
críticamente enfermos con otros factores de riesgo de IRA.
Estudios neonatales multicéntricos han demostrado que existen diferencias significativas en la epidemiología de la IRA entre las instituciones [8], quizás debido a diferencias en las poblaciones de pacientes o las prácticas clínicas. Sin embargo, en el estudio AWAKEN, los sitios que midieron la SCr con mayor frecuencia tenían tasas mucho más altas de IRA que los sitios que lo midieron con poca frecuencia, lo que sugiere que la adquisición de datos puede ser un factor importante en las diferencias [46]. Por lo tanto, creemos que capturar las tasas de monitoreo de la SCr es esencial para comprender la prevalencia de IRA a nivel de población. Es importante comprender las tasas de IRA institucional de referencia o basales antes de implementar intervenciones diseñadas para mejorar los outcomes. Se necesita un mayor desarrollo, validación y uso de tales métricas utilizando la metodología integral de mejora de la calidad descrita en Figura 2 para ayudar a identificar oportunidades para mejorar la atención.
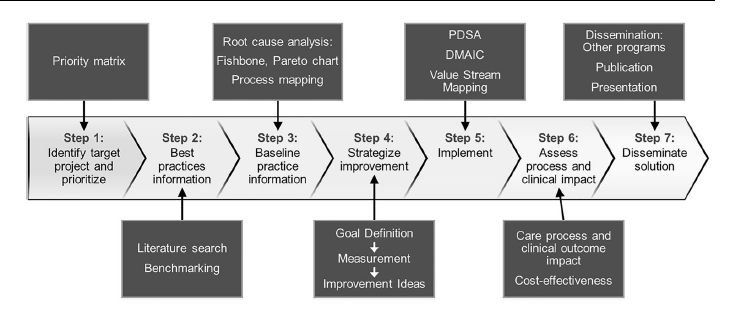
Figura 2.- Metodología de mejora de la calidad. Se necesitaban tomar siete pasos para un proyecto de mejora de la calidad exitoso. Reimpreso de Acute Disease Quality Initiative (ADQI) [25].
Prevención Secundaria de AKI
Pregunta 1: ¿Cuáles son
las consideraciones claves para desarrollar programas de calidad que
evalúen a los contribuyentes a un episodio de LRA?
Declaración de consenso A : Para cada paciente diagnosticado con AKI durante la hospitalización, el objetivo es la recuperación de la función renal inicial en el período más corto de tiempo con un número mínimo de complicaciones.
Esto se logra mejor mediante un diagnóstico y tratamiento oportunos y precisos de IRA.
Declaración de consenso B : La MC en torno a evaluación diagnóstica de IRA debe intentar maximizar la proporción de pacientes que se someten a una evaluación oportuna y adecuada al contexto, evitando pruebas innecesarias.
Los autores están de acuerdo con las afirmaciones anteriores ya que se relacionan con la prevención secundaria de la IRA neonatal. La prevención secundaria de IRA abarca un enfoque de dos vertientes dirigido a la mitigación de la gravedad de la LRA y la prevención de las complicaciones de la LRA. Las medidas preventivas secundarias diseñadas para detener la progresión incluyen estrategias diseñadas para aliviar las causas potencialmente reversibles de IRA , tales como hipovolemia, presión oncótica baja, obstrucción urinaria e hipertensión intraabdominal. También se deben implementar estrategias (ej; limitar los medicamentos nefrotóxicos en pacientes con IRA, optimizar la hemodinámica) diseñadas para reducir IRA durante los eventos de alto riesgo. Después de un diagnóstico oportuno de AKI, las medidas de mejora de la calidad destinadas a reducir la gravedad y la duración de los episodios de AKI deben centrarse en los factores potencialmente modificables y las consecuencias limitantes (ej; hiperpotasemia, sobrecarga de líquidos, acidosis) durante su hospitalización.
El desarrollo, implementación y diseminación de un “Paquete preventivo de AKI Neonatal” es un objetivo significativo para la comunidad de nefrología neonatal. Los esfuerzos para desarrollar paquetes de IRA específicos al contexto han tenido éxito en adultos [47-52], pero los datos están recién ahora disponibles en la comunidad neonatal [53]. Estos paquetes deberían enfocarse en educación, evaluación de riesgos, diagnóstico oportuno, intervenciones, mitigación de consecuencias y monitoreo terapéutico. Nuevamente, aprovechar el EMR puede permitir a los médicos el reconocimiento oportuno de la IRA y la evaluación de métricas críticas.
Pregunta 2: ¿Cuáles son
las consideraciones claves para desarrollar programas de MC
enfocados en limitar la duración y severidad de la LRA?
Declaración de consenso A : Los programas de MC deben incluir la implementación y el informe de la proporción de pacientes que reciben intervenciones oportunas y apropiadas para el diagnóstico. Los autores están de acuerdo en que los programas de mejora de la calidad no solo deben desarrollar el proceso de atención, sino que también deben capturar la coherencia en la aplicación de los procesos de atención estandarizados. Estos incluyen medidas de la frecuencia de la evaluación de IRA (es decir, porcentaje de pacientes de alto riesgo para los que se mide SCr), diagnóstico oportuno, intervenciones apropiadas de las estrategias diseñadas para reducir IRA. Estos datos deben estar disponibles para todas las partes interesadas.
Pregunta 3: ¿Cuáles son las consideraciones claves para desarrollar programas de MC enfocados en reducir las complicaciones de la LRA ?
Declaración de consenso A : Los indicadores de calidad para la prevención de complicaciones evitables relacionadas con IRA incluyen monitoreo o seguimiento, notificación de eventos adversos específicos del contexto (a los defensores de los pacientes, clínicos, administradores y organismos reguladores) y la implementación de estrategias de reducción de riesgos.
Los datos emergentes sugieren que las consecuencias de IRA, tales como la sobrecarga de líquidos, las alteraciones electrolíticas y ácido / base e hipertensión, son comunes y se asocian con malos resultados en todo el espectro de edades. Se han realizado algunos estudios neonatales que muestran el impacto negativo de la sobrecarga de líquidos e IRA [2, 41]. Se necesitan programas de mejora de la calidad diseñados para limitar la sobrecarga de líquidos neonatal en el contexto de un paciente con riesgo de IRA o AKI.
Se necesitan más estudios en pacientes neonatales para determinar el balance hídrico óptimo durante la transición del nacimiento y durante los eventos de alto riesgo para IRA. Deben estudiarse estrategias para reducir otras consecuencias de IRA (tales como hiperpotasemia, acidosis) ya que pueden conducir a una mejora de los outcomes o resultados. Una vez que se hayan realizado más investigaciones sobre las complicaciones y las consecuencias y se hayan delineado más claramente, los organismos reguladores neonatales más grandes pueden utilizar esta información para implementar estrategias de reducción de riesgos.
Indicadores de Calidad de Terapia de reemplazo renal
Pregunta 1: ¿Cómo se debe
monitorear, evaluar e informar la calidad de la terapia de reemplazo
renal aguda ?
Declaración de consenso A : Los indicadores de calidad deben integrar la estructura, el proceso y los indicadores de outcome para cada modalidad terapéutica.
Los autores coinciden con el informe de la 22ª ADQI de que la incorporación de indicadores de calidad debe ser parte de los programas que brinden terapia de reemplazo renal agudo a los recién nacidos. La terapia de reemplazo de riñón (TRK) en recién nacidos ha sido un desafío debido a la falta de tecnología para pacientes pequeños. Nuestro grupo no abordó la modalidad y el momento de la terapia, pero el grupo tiene una fuerte opinión de que los programas deben utilizar metodologías de mejora de la calidad para garantizar una atención segura y de alta calidad a los recién nacidos que reciben terapia de apoyo renal. La diálisis peritoneal (DP), la hemodiálisis (HD) y la terapia de reemplazo renal continua (CKRT) se han utilizado durante décadas para ayudar a los recién nacidos con insuficiencia renal, y la determinación de la terapia se basa en las características del paciente, los recursos institucionales y la experiencia del proveedor. . Las terapias extracorpóreas plantean al recién nacido un riesgo mucho mayor de inestabilidad hemodinámica debido al gran volumen extracorpóreo cuando se utilizan tubos y filtros diseñados para adultos.
Además, las tasas de error en los dispositivos de suministro de fluido y las bombas de extracción de fluido presentan tasas de error relativas mucho más altas. El uso reciente de máquinas con circuitos pequeños ha mitigado estos riesgos y está comenzando a cambiar la práctica del soporte renal neonatal en algunos programas [54-56]. A medida que estas máquinas continúen incorporándose a las UCIN de todo el mundo, será fundamental documentar e instituir herramientas de MC (Mejora de Calidad) para rastrear, mejorar y evolucionar esta terapia. La CKRT neonatal debe considerarse como cualquier otro procedimiento complejo y de alto riesgo. Cada programa debe tener políticas y procedimientos delineados, roles y responsabilidades claramente definidos para todos los miembros del equipo, garantizar la capacitación adecuada, desarrollar listas de verificación de procedimientos (cheklist) , establecer tiempos de espera antes del inicio y realizar evaluaciones de mejora continua de la calidad.
Todos los programas deben integrar medidas
estructurales, de procesos y resultados dentro del contexto de un
marco de mejora de la calidad. Los programas deben centrarse en los
elementos más importantes que captarán las fortalezas y debilidades
del programa y pueden incluir procesos para optimizar el inicio de
la terapia, evaluar la eficiencia de la terapia, evaluar las
habilidades del proveedor y evaluar la seguridad del paciente [57].
La mejora de la calidad en la CKRT debe buscar optimizar el momento
del inicio, evaluar los eventos de seguridad y optimizar la
eficiencia de la terapia. Los datos de MC también son importantes
para justificar la necesidad de tecnologías específicas para recién
nacidos.
Pregunta 2: ¿ Cuáles son los indicadores mínimos de calidad de la estructura que deben implementarse para TRR (terapia de reemplazo renal) aguda ?
Declaración de consenso A : Los indicadores de calidad estructural deben apuntar específicamente a la capacidad y experiencia de los médicos, enfermeras y profesionales de la salud afines para proporcionar KRT aguda e identificar un team responsable para implementar y reportar métricas de calidad para los servicios de KRT aguda.
Estamos de acuerdo con esta afirmación. Creemos que la administración de TRR aguda para recién nacidos y bebés en estado crítico es una asociación entre nefrólogos y neonatólogos (o intensivistas) debido a la complejidad del procedimiento, los procesos de la enfermedad y los objetivos de la atención. Los programas que proporcionan TRR aguda en recién nacidos deben tener una infraestructura sólida.
El programa debe tener un equipo o team multidisciplinario dedicado con las habilidades y el equipo necesarios para proporcionar TRR aguda a los recién nacidos. Este equipo debe tener médicos y enfermeras que hayan asignado tiempo administrativo para permitirles desarrollar y mantener el programa [57]. Como mínimo, esto incluye el desarrollo de procedimientos, políticas, currículos educativos, así como la determinación de indicadores de calidad apropiados, recolección de datos, análisis de datos y evaluación de programas [57, 58]. El equipo o team debe incorporar a otros médicos, proveedores de práctica avanzada, enfermeras clínicas especializadas, enfermeras de cabecera, farmacéuticos clínicos y dietistas con educación y experiencia específicas en la atención de IRA. Un programa exitoso debe capacitar adecuadamente a los proveedores de atención, lo que incluye capacitación en la prescripción de terapias a médicos y enfermeras así como la capacitación del personal que iniciará y mantendrá la terapia.
Fundamental para la atención del recién nacido en estado crítico que necesita TRR aguda, las instituciones deben determinar si la atención se debe brindar en la UCIN o si lo mejor para el niño es transferirlo a un lugar dentro del hospital (ej; UCIP ) que tenga la capacitación y habilidades para brindar atención. Si la institución no cuenta con la capacitación o el equipo para proporcionar TRR aguda, deben considerar la posibilidad de trasladar al paciente a un hospital que sí lo tenga.
Pregunta 3: ¿Cuáles son los indicadores mínimos de calidad del proceso que deben implementarse para la provisión de TRR (terapia de reemplazo renal) aguda?
Declaración de consenso A : Los indicadores de calidad del proceso deben incorporar metodologías que conduzcan a protocolos y procedimientos estandarizados, que permitan una mayor eficiencia y coherencia en la atención y la seguridad, y deben ser específicos para cada modalidad de TRR.
Estamos de acuerdo con esta afirmación. Las medidas de proceso asesoran y evalúan la prestación de atención para todas las formas de KST aguda (PD, HD y CRRT). Es necesario centrarse en la estandarización y la eliminación de la variación de la práctica dentro de los proveedores para brindar una atención de reemplazo renal segura y eficiente. Se deben desarrollar protocolos y procedimientos de práctica estándar utilizando las mejores prácticas identificadas y basadas en la evidencia actual. Las políticas, los protocolos y los procedimientos deben orientar las prácticas a lo largo de la continuidad de la atención de IRA desde la consulta inicial hasta la interrupción del tratamiento.
Tanto para la DP (diálisis
peritoneal) como para las
terapias extracorpóreas, recomendamos que las complicaciones, los
eventos de seguridad, la vida útil del filtro y las métricas de
acceso vascular (ej; proporción de catéteres / tratamiento, número de revisiones del catéter, infección, el cumplimiento
de las guías de colocación) se incorporen al proceso de
evaluaciones de cuidados [59]. Se deben utilizar Guías basadas en
el peso para recomendar el tamaño y la ubicación del acceso vascular
[60] y se deben considerar los catéteres tunelizados con manguito
tanto para DP como para terapias extracorpóreas si se espera que la
duración de la terapia sea prolongada. El momento óptimo para el
inicio de la TRR aguda sigue siendo un área activa de investigación
en otras poblaciones, pero no se ha explorado en recién nacidos.
Recomendamos que las iniciativas de calidad incluyan la medición del
estado de sobrecarga de líquidos y la estadificación de la IRA en el
momento del inicio del tratamiento [61, 62]. El inicio de la DP
aguda y las terapias extracorpóreas debe realizarse de acuerdo con
las prácticas establecidas asociadas con todos los procedimientos
críticos. Estas prácticas incluyen realizar un "tiempo de espera"
utilizando una lista de verificación (cheklist) para revisar el procedimiento
prescrito, la revisión de la prescripción, los objetivos de signos
vitales y el primer y segundo tratamiento para cambios en los signos
vitales.
Además, en cada procedimiento de inicio de la terapia extracorpórea
neonatal, debe estar presente un proveedor (médico, asistente médico
o enfermera especializada en cuidados intensivos y nefrología).
Pregunta 4: ¿ Cuáles son los indicadores de resultado mínimos que deben implementarse para la provisión de TRR aguda?
Declaración de consenso A : Los indicadores de calidad de los resultados deben incluir los resultados centrados en el paciente, incluida la satisfacción del médico y del paciente, la mortalidad y la calidad de vida de los supervivientes; tasas de liberación de diálisis; y outcomes de salud económicos.
Estamos de acuerdo con esta afirmación. Las instituciones deben realizar un seguimiento de las medidas de resultado del sistema y las métricas específicas de los neonatos deben incluir los resultados nefrológicos , así como la comprensión y la satisfacción de los padres.
Prevención terciaria de complicaciones de AKI a corto y largo plazo
Pregunta 1: ¿Cómo se debe medir la atención adecuada después de una IRA (injuria renal aguda) ?
Declaración de consenso A : Los sistemas de cuidado de salud deben cuantificar la proporción de pacientes que necesitan seguimiento posterior a una AKI , los que reciben algún seguimiento posterior a una AKI y evaluar la calidad de la atención de los que recibieron un seguimiento post AKI.
Los programas deben buscar optimizar el seguimiento como paso final en la atención de los pacientes neonatales después de un episodio de IRA. Se deben realizar esfuerzos para asegurar que se programen las visitas de seguimiento y que la información clínica crítica se comunique con los proveedores ambulatorios. En el nivel más básico, las listas de problemas deben actualizarse y revisarse para verificar su precisión en lo que respecta a los episodios de IRA. Esto asegura que los proveedores puedan reconocer a aquellos en riesgo de futuros episodios de AKI, especialmente aquellos que previamente han experimentado múltiples episodios de AKI. La atención de seguimiento puede requerir el desarrollo de clínicas de seguimiento específicas de AKI en instituciones pediátricas más especializadas.
Como mínimo, los
siguientes grupos justifican el seguimiento por parte de nefrólogos
pediátricos 3 meses después del alta aquellos con antecedentes de
IRA o AKI grave (estadio 2, estadio 3 o terapia de apoyo renal), episodios
múltiples de IRA, episodios de IRA de larga duración (> 7 días ) y
niños con otros factores de riesgo de ERC (ej; cardiopatía
congénita, prematuridad extrema y muy bajo peso al nacer). Se
necesitan más investigaciones y análisis de costos para determinar
qué proveedores (PCP, clínicas de seguimiento de UCIN, nefrólogos
pediátricos), cuales pruebas y qué frecuencia de seguimiento en bebés
de alto riesgo se necesita después de IRA. Exclusivo para los
recién nacidos, es necesario estudiar si una recuperación de IRA
(versus la progresión a ERC) afecta los resultados del desarrollo
neurológico y la calidad de vida.
Pregunta 2: ¿Cuáles son los elementos clave de un paquete de atención adecuado después de una IRA?
Declaración de consenso A : Los indicadores de calidad deben incluir al menos la estructura (personal y recursos necesarios), el proceso de seguimiento (quién y quién, qué, dónde, cuándo, por qué y cómo) e indicadores de outcome (progresión de ERC, continuación o nueva necesidad de diálisis, mortalidad, etc.)
Para garantizar un seguimiento adecuado, los recién nacidos y los bebés con alto riesgo de ERC, como se describe anteriormente, deben tener el seguimiento inicial realizado por un nefrólogo pediátrico u otro proveedor de atención adecuado dentro de los 3 meses posteriores al alta, según lo recomendado por las Guias de KDIGO. [60]. Este seguimiento debe incluir mediciones de la función renal y la presión arterial. La duración posterior del seguimiento debe determinarse en función de la presencia y el riesgo de ERC posterior, la disponibilidad de recursos locales y la voluntad de los médicos de atención primaria de seguir a los pacientes con riesgo de ERC. Los estudios de seguimiento de la IRA neonatal han demostrado que la disfunción renal se puede detectar a los 2 años de edad [12, 13], pero es necesario realizar más estudios de investigación a gran escala para determinar el momento óptimo y las ubicaciones de seguimiento para recién nacidos con riesgo de ERC.
Resumen
La IRA neonatal (injuria
renal aguda) está ahora
bien definida y se ha identificado como un contribuyente importante
a la morbilidad y mortalidad neonatal. La Declaración de
Consenso de la 22ª ADQI ha proporcionado valiosas recomendaciones sobre
cómo los cambios sistemáticos pueden tener un impacto positivo en el
cuidado de todos los pacientes con AKI. Para aclarar aún más cómo
se pueden aplicar estas recomendaciones a los recién nacidos,
proporcionamos una respuesta paralela a cada declaración desde la
perspectiva del cuidado clínico neonatal. Reconocemos que pocos
programas de la UCIN participan actualmente en programas de QI de
AKI, pero instamos a la comunidad a comenzar para que la calidad del
cuidado para los recién nacidos con y en riesgo de AKI pueda
comenzar a mejorar. Proponemos que cada UCIN establezca su propio
enfoque de QI de AKI neonatal utilizando los recursos y equipos
disponibles. Recomendamos que cada UCIN implemente los elementos de
este informe, que crea que son los más importantes y factibles.
Referencias
-
Stoops C, Boohaker L, Sims B, Griffin R, Selewski DT, Askenazi D, et al. The association of intraventricular hemorrhage and acute kidney injury in premature infants from the assessment of the worldwide acute kidney injury epidemiology in neonates (AWAKEN) study. Neonatology. 2019;116:321–30.
-
Selewski DT, Gist KM, Nathan AT, Goldstein SL, Boohaker LJ, Akcan-Arikan A, et al. The impact of fluid balance on outcomes in premature neonates: a report from the AWAKEN study group. Pediatr Res. 2020;87:550–7.
-
Kirkley MJ, Boohaker L, Griffin R, Soranno DE, Gien J, Askenazi D, et al. Acute kidney injury in neonatal encephalopathy: an evaluation of the AWAKEN database. Pediatr Nephrol. 2019;34:169–76.
-
Charlton JR, Boohaker L, Askenazi D, Brophy PD, Fuloria M, Gien J, et al. Late onset neonatal acute kidney injury: results from the AWAKEN Study. Pediatr Res. 2019;85:339–48.
-
Charlton JR, Boohaker L, Askenazi D, Brophy PD, D’Angio C, Fuloria M, et al. Incidence and risk factors of early onset neonatal AKI. Clin J Am Soc Nephrol. 2019;14:184.
-
Kraut EJ, Boohaker LJ, Askenazi DJ, Fletcher J, Kent AL. Incidence of neonatal hypertension from a large multicenter study [assessment of worldwide acute kidney injury epidemiology in neonates-AWAKEN]. Pediatr Res. 2018;84:279–89.
-
Bakhoum CY, Basalely A, Koppel RI, Sethna CB. Acute kidney injury in preterm infants with necrotizing enterocolitis. J Matern Fetal Neonatal Med. 2019;32:3185–90.
-
Jetton JG, Boohaker LJ, Sethi SK, Wazir S, Rohatgi S, Soranno DE, et al. Incidence and outcomes of neonatal acute kidney injury (AWAKEN): a multicentre, multinational, observational cohort study. Lancet Child Adolesc Health. 2017;1:184–94.
-
Ueno K, Seki S, Shiokawa N, Matsuba T, Miyazono A, Hazeki D, et al. Validation of acute kidney injury according to the modified KDIGO criteria in infants after cardiac surgery for congenital heart disease. Nephrology. 2019;24:294–300.
-
Srinivasan N, Schwartz A, John E, Price R, Amin S. Acute kidney injury impairs postnatal renal adaptation and increases morbidity and mortality in very low-birth-weight infants. Am J Perinatol. 2018;35:39–47.
-
Madsen NL, Goldstein SL, Frøslev T, Christiansen CF, Olsen M. Cardiac surgery in patients with congenital heart disease is associated with acute kidney injury and the risk of chronic kidney disease. Kidney Int. 2017;92:751–6.
-
Maqsood S, Fung N, Chowdhary V, Raina R, Mhanna MJ. Outcome of extremely low birth weight infants with a history of neonatal acute kidney injury. Pediatr Nephrol. 2017;32: 1035–43.
-
Harer MW, Pope CF, Conaway MR, Charlton JR. Follow-up of acute kidney injury in neonates during childhood years (FANCY): a prospective cohort study. Pediatr Nephrol. 2017;32:1067–76.
-
Abitbol CL, Bauer CR, Montane B, Chandar J, Duara S, Zilleruelo G. Long-term follow-up of extremely low birth weight infants with neonatal renal failure. Pediatr Nephrol. 2003;18:887–93.
-
Crump C, Sundquist J, Sundquist K. Risk of hypertension into adulthood in persons born prematurely: a national cohort study. Eur Heart J. 2020;41:1542–50.
-
Calderon-Margalit R, Golan E, Twig G, Leiba A, Tzur D, Afek A, et al. History of childhood kidney disease and risk of adult endstage renal disease. N. Engl J Med. 2018;378:428–38.
-
Low Birth W. Nephron number working G. The impact of kidney development on the life course: a consensus document for action. Nephron. 2017;136:3–49.
-
Stritzke A, Thomas S, Amin H, Fusch C, Lodha A. Renal consequences of preterm birth. Mol Cell Pediatr. 2017;4:2.
-
Luyckx VA. Preterm birth and its impact on renal health. Semin Nephrol. 2017;37:311–9.
-
Chaturvedi S, Ng KH, Mammen C. The path to chronic kidney disease following acute kidney injury: a neonatal perspective. Pediatr Nephrol. 2017;32:227–41.
-
Khalsa DDK, Beydoun HA, Carmody JB. Prevalence of chronic kidney disease risk factors among low birth weight adolescents. Pediatr Nephrol. 2016;31:1509–16.
-
White SL, Perkovic V, Cass A, Chang CL, Poulter NR, Spector T, et al. Is low birth weight an antecedent of CKD in later life? A systematic review of observational studies. Am J Kidney Dis. 2009;54:248–61.
-
Zappitelli M, Ambalavanan N, Askenazi DJ, Moxey-Mims MM, Kimmel PL, Star RA, et al. Developing a neonatal acute kidney injury research definition: a report from the NIDDK neonatal AKI workshop. Pediatr Res. 2017;82:569–73.
-
Jetton JG, Sorenson M. Pharmacological management of acute kidney injury and chronic kidney disease in neonates. Semin Fetal Neonatal Med. 2017;22:109–15.
-
Kashani K, Rosner MH, Haase M, Lewington AJP, O’Donoghue DJ, Wilson FP, et al. Quality improvement goals for acute kidney injury. Clin J Am Soc Nephrol. 2019;14:941–53.
-
Silver SA, Nadim MK, O’Donoghue DJ, Wilson FP, Kellum JA, Mehta RL, et al. Community health care quality standards to prevent acute kidney injury and its consequences. Am J Med. 2020;133:552–60.e3.
-
Rewa OG, Tolwani A, Mottes T, Juncos LA, Ronco C, Kashani K, et al. Quality of care and safety measures of acute renal replacement therapy: Workgroup statements from the 22nd acute disease quality initiative (ADQI) consensus conference. J Crit Care. 2019;54:52–7.
-
Selby NM, Casula A, Lamming L, Stoves J, Samarasinghe Y, Lewington AJ, et al. An organizational-level program of intervention for AKI: a pragmatic stepped wedge cluster randomized trial. J Am Soc Nephrol. 2019;30:505.
-
Meersch M, Schmidt C, Hoffmeier A, Van Aken H, Wempe C, Gerss J, et al. Prevention of cardiac surgery-associated AKI by implementing the KDIGO guidelines in high risk patients identified by biomarkers: the PrevAKI randomized controlled trial. Intensive Care Med. 2017;43:1551–61.
-
Romagnoli S, Ricci Z, Ronco C. Perioperative acute kidney injury: prevention, early recognition, and supportive measures. Nephron. 2018;140:105–10.
-
Perico N, Askenazi D, Cortinovis M, Remuzzi G. Maternal and environmental risk factors for neonatal AKI and its long-term consequences. Nat Rev Nephrol. 2018;14:688–703.
-
Flynn JT, Kaelber DC, Baker-Smith CM, Blowey D, Carroll AE, Daniels SR, et al. Clinical practice guideline for screening and management of high blood pressure in children and adolescents. Pediatrics. 2017;140:e20171904.
-
Joseph C, Gattineni J. Proteinuria and hematuria in the neonate. Curr Opin Pediatr. 2016;28:202–8.
-
Ojala R, Ala-Houhala M, Harmoinen AP, Luukkaala T, Uotila J, Tammela O. Tubular proteinuria in pre-term and full-term infants. Pediatr Nephrol. 2006;21:68–73.
-
Jernigan SM. Hematuria in the newborn. Clin Perinatol. 2014;41: 591–603.
-
Jones RW, Rochefort MJ, Baum JD. Increased insensible water loss in newborn infants nursed under radiant heaters. Br Med J. 1976;2:1347–50.
-
Goldstein SL, Dahale D, Kirkendall ES, Mottes T, Kaplan H, Muething S, et al. A prospective multi-center quality improvement initiative (NINJA) indicates a reduction in nephrotoxic acute kidney injury in hospitalized children. Kidney Int. 2020;97:580–8.
-
Goldstein SL, Kirkendall E, Nguyen H, Schaffzin JK, Bucuvalas J, Bracke T, et al. Electronic health record identification of nephrotoxin exposure and associated acute kidney injury. Pediatrics. 2013;132: e756–67.
-
Goldstein SL, Mottes T, Simpson K, Barclay C, Muething S, Haslam DB, et al. A sustained quality improvement program reduces nephrotoxic medication-associated acute kidney injury. Kidney Int. 2016;90:212–21.
-
Stoops C, Stone S, Evans E, Dill L, Henderson T, Griffin R, et al. Baby NINJA (nephrotoxic injury negated by just-in-time action): reduction of nephrotoxic medication-associated acute kidney injury in the neonatal intensive care unit. J Pediatr. 2019;215:e226.
-
Selewski DT, Akcan-Arikan A, Bonachea EM, Gist KM, Goldstein SL, Hanna M, et al. The impact of fluid balance on outcomes in critically ill near-term/term neonates: a report from the AWAKEN study group. Pediatr Res. 2019;85:79–85.
-
Bhojani S, Stojanovic J, Melhem N, Maxwell H, Houtman P, Hall A, et al. The incidence of paediatric acute kidney injury identified using an AKI E-alert algorithm in six english hospitals. Front Pediatr. 2020;8:29.
-
Van Driest SL, Wang L, McLemore MF, Bridges BC, Fleming GM, McGregor TL, et al. Acute kidney injury risk-based screening in pediatric inpatients: a pragmatic randomized trial. Pediatr Res. 2020;87:118–24.
-
Sandokji I, Yamamoto Y, Biswas A, Arora T, Ugwuowo U, Simonov M, et al. A time-updated, parsimonious model to predict AKI in hospitalized children. J Am Soc Nephrol. 2020;31:1348–57.
-
Benoit SW, Goldstein SL, Dahale DS, Haslam DB, Nelson A, Truono K, et al. Reduction in nephrotoxic antimicrobial exposure decreases associated acute kidney injury in pediatric hematopoietic stem cell transplant patients. Biol Blood Marrow Transplant. 2019;25:1654–8.
-
Jetton JG, Guillet R, Askenazi DJ, Dill L, Jacobs J, Kent AL, et al. Assessment of worldwide acute kidney injury epidemiology in neonates: design of a retrospective cohort study. Front Pediatrics. 2016;4:68.
-
Bagshaw SM. Acute kidney injury care bundles. Nephron. 2015; 131:247–51.
-
Logan R, Davey P, Davie A, Grant S, Tully V, Valluri A, et al. Care bundles for acute kidney injury: a balanced accounting of the impact of implementation in an acute medical unit. BMJ Open Qual. 2018;7:e000392.
-
Meijers B, De Moor B, Van Den Bosch B. The acute kidney injury e-alert and clinical care bundles: the road to success is always under construction. Nephrol Dial Transplant. 2016;31:1761–3.
-
Schiffl H. Prevention of severe acute kidney injury by implementation of care bundles: some progress but still a lot of work ahead. Saudi J Kidney Dis Transplant. 2018;29:513–7.
-
Selby NM, Kolhe NV. Care bundles for acute kidney injury: do they work? Nephron. 2016;134:195–9.
-
Selby NM, Casula A, Lamming L, Stoves J, Samarasinghe Y, Lewington AJ, et al. An organizational-level program of intervention for AKI: a pragmatic stepped wedge cluster randomized trial. J Am Soc Nephrol. 2019;30:505–15.
-
Vincent K, Murphy HJ, Ross JR, Twombley KE. Acute kidney injury guidelines are associated with improved recognition